
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Pt l Ox, Red
|
|
|
|
Процессы же окисления и восстановления протекают между веществами, находящимися в растворе.
Условно такой электрод можно изобразить так:
Предположим, что электрод состоит из платины, погруженной в раствор, содержащий ионы Fe2+ и Fe3+.
На этом электроде протекает процесс:
Fe3+ + e ⇆ Fe2+
Электродный потенциал этого окислительно-восстановительного электрода выражается уравнением Петерса: 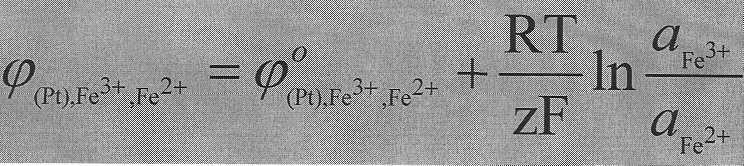
Уравнение Петерса
в общем виде имеет вид:
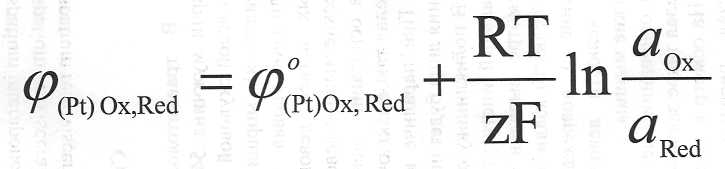 где
где 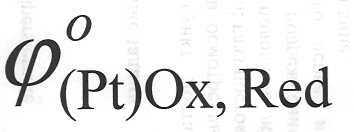 – это стандартный электродный потенциал
– это стандартный электродный потенциал
окислительно-восстановительного электрода при одинаковой активности в растворе окисленной и восстановленной форм;
а(ОХ) и а(Red) – активность (концентрация) окисленной и восстановленной форм веществ в Redox-системе.
Величина редокс-потенциала зависит не только от активностей окисленной и восстановленной форм, но и от активности ионов водорода, участвующих в восстановлении систем.
Например, редокс-потенциал электрода, на котором протекает процесс
MnO4- + 5е + 8 H + ⇄ Mn2+ + 4Н2О
определяется уравнением: 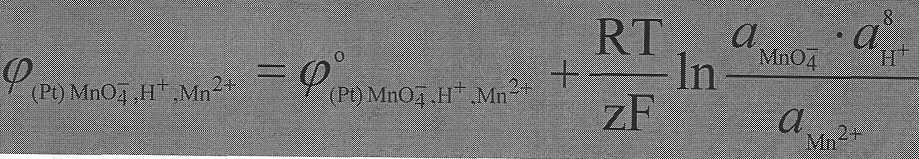
Потенциометрией называется физико-химический метод анализа, позволяющий определять активности (концентрации) ионов на основании измерения ЭДС гальванической цепи, состоящей из электрода сравнения и электрода определения, опущенных в исследуемый раствор.
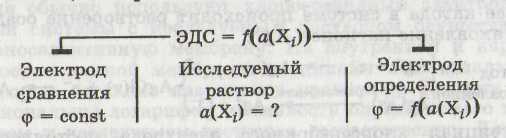
n ЭДС (Е) = φ2(+) – φ(-)
n = φкатода - φанода
n = φок-ля – φвосст-ля
n Электродом сравнения называется электрод, потенциал которого практически постоянен.
n Принятым электродом сравнения является стандартный водородныйэлектрод.
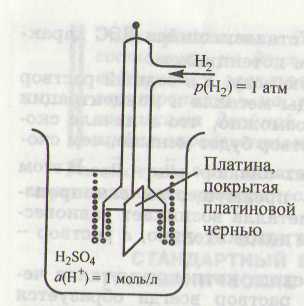
Стандартный водородный электрод
Схематично стандартный водородный электрод записывают так:
Pt, H2 [p(H2) = 1 атм./Н+ [a(H+) = 1 моль/л]
 На водородном электроде протекают обратимые процессы:
На водородном электроде протекают обратимые процессы:
|
|
|
Н2 ↔ 2Н ↔ 2Н+ + 2е
Потенциал стандартного водородного электрода условно принят за нуль
при любой температуре.
Если Р ≠ 1 атм.
или а(Н+) ≠ 1 моль/л, то φ ≠ φо ≠ 0
φ электрода рассчитывается по формуле: 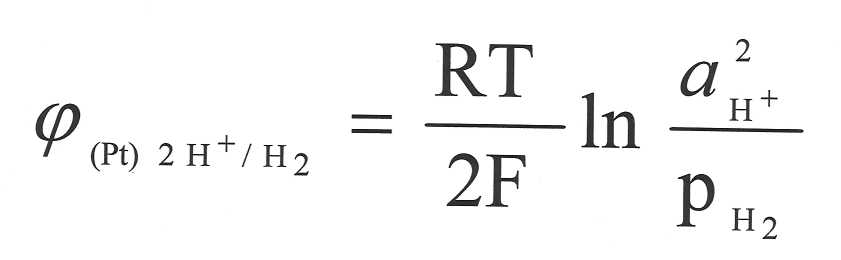
При стандартной температуре уравнение Нернста для водородного электрода имеет вид:
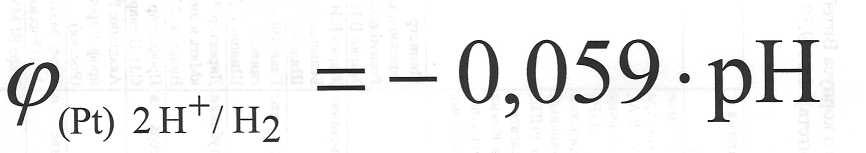
Электродом определения называется электрод, потенциал которого зависит от активности (концентрации) анализируемых ионов.
На практике в качестве электродов определения используются
ионо-селективные электроды.
Для измерения концентрации биологически активных ионов: Н+, Na+, К+, NH4+, Са2+ и других, а также различных веществ в биологических системах используют электроды определения, которые называют также индикаторными электродами.
Электродами определения прежде всего являются мембранные ионоселективные электроды, мембрана которых способна адсорбировать или пропускать только определенные ионы.
Наиболее широко используется в качестве ионоселективного электрода определения стеклянный электрод. ЭДС гальванической цепи из ионоселективного электрода определения и электрода сравнения, опущенных в исследованный раствор определяют с помощью иономера (рН метра): 
Стеклянный электрод 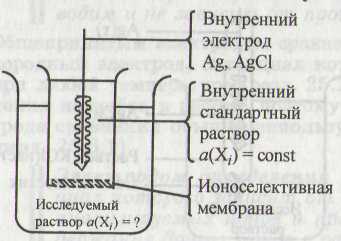
На поверхности мембраны стеклянного электрода протекает процесс: Ме+ (стекло) + Н+ (раствор) ↔
Н+(стекло) + Ме+(раствор)
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1042; Нарушение авторских прав?; Мы поможем в написании вашей работы!