
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дифениламин
|
|
|
|
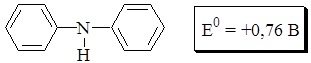
Дифениламин малорастворим в воде (для приготовления его растворов используют концентрированную серную кислоту). Более удобными для практического применения являются водорастворимые аналоги дифениламина, применяемые в виде различных солей.
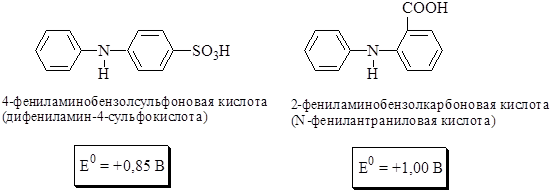
Окисление дифениламина протекает в 2 стадии
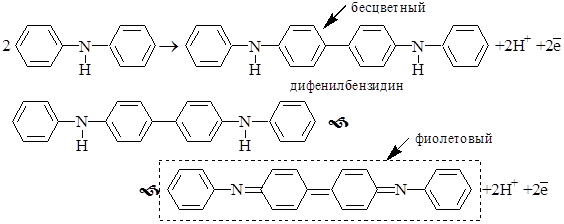
Дифениламин и его производные являются одноцветными индикаторами. Их окисленная форма фиолетовая с различными оттенками в зависимости от заместителей, восстановленная – бесцветна. В процессе восстановления индикаторов из группы дифениламина участвуют протоны, поэтому величина электродного потенциала у этих веществ зависит от рН (рядом с формулами приведены значения E0 для рН 0).
Ферроин – это комплекс катионов железа с фенантролином.
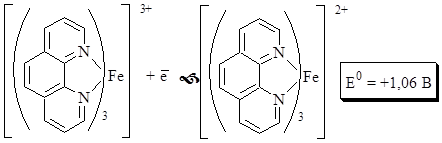
Ферроин - двухцветный индикатор, но интенсивность окраски у различных его форм неодинакова. Восстановленная форма имеет интенсивную красно-оранжевую окраску, окисленная – бледно-голубую. В отличие от дифениламина его окислительно-восстановительные свойства в значительно меньшей степени зависят от рН.
6. Общая фармакопейная статья ГФ РБ «Реакции подлинности (идентификации) на ионы и функциональные группы». Реакции идентификации неорганических катионов: алюминий,аммония соли, аммония соли и соли летучих оснований, висмут, железо, калий, кальций, магний, натрий, ртуть, свинец, серебро, сурьма, цинк.
1., Al3+ + 3OH- ® Al(OH)3¯
белый
Al3+ + 3NH3 + 3H2O ® Al(OH)3¯ + 3NH4+
Осадок растворяется в кислотах и щелочах (а также частично в растворе NH3 в зависимости от его рН, устойчивых аммиачных комплексов ион алюминия не образует).
Al(OH)3¯ + 3H+ ® Al3+ + 3H2O Al(OH)3¯ + OH- ® [Al(OH)4]-
При добавлении к щелочному раствору Na[Al(OH)4] хлорида аммония рН раствора понижается и выпадает осадок Al(OH)3.
|
|
|
[Al(OH)4]- + NH4+ ® Al(OH)3¯ + NH3 + H2O
3. NH4+ + OH- 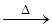 NH3 + H2O
NH3 + H2O
4. Bi3+ + n SC(NH2)2 ® {Bi[SC(NH2)2]n}3+
лимонно-жёлтый
Bi3+ + 3I - ® BiI3¯
чёрный
Осадок растворяется в избытке реагента
BiI3 + KI ® K[BiI4]
оранжевый
5. Fe2+ + K+ + [Fe(CN)6]3- ® KFe[Fe(CN)6]¯
синий
или Fe2+ + [Fe(CN)6]3- ® [Fe2(CN)6]-
Fe3+ + K+ + [Fe(CN)6]4- ® KFe[Fe(CN)6]¯
синий
или Fe3+ + [Fe(CN)6]4- ® [Fe2(CN)6]-
Осадок нерастворим в кислотах, разрушается щелочами. Он имеет такой же состав, как и продукт реакции Fe2+ + [Fe(CN)6]3-.
4. Тиоцианат калия или аммония (KSCN, NH4SCN)
Fe3+ + nSCN- ® [Fe(SCN)n]3-n
кроваво-красный
6. 2K+ + Na+ + [Co(NO2)6]3- ® K2Na[Co(NO2)6] ¯
жёлтый кристаллический
K+ + HC4H4O6- ® KHC4H4O6 ¯
белый кристаллический
7. Са2+ + C2O42- ® СаC2O4¯
белый
Ca2+ + K+ + NH4+ + [Fe(CN)6]4- ® NH4KCa[Fe(CN)6]¯
белый
8. Mg2+ + HPO42- + NH3 ® MgNH4PO4¯
белый кристаллический
Mg2+ + 2OH- ® Mg(OH)2 ¯
9. Na+ + [Sb(OH)6]- ® Na[Sb(OH)6] ¯
белый кристаллический
10. Hg2+ + 2OH- ® HgO¯ + H2O
жёлтый
Hg2+ + Cu¯ ® Hg¯ + Cu2+
серебристый налёт
Hg2+ + 2I- ® HgI2¯
оранжево-красный
Осадок растворим в избытке реагента
HgI2¯ + 2I- ® [HgI4]2-
бесцветный
11. Pb2++ СrO42-® PbCrO4¯
жёлтый
Pb2+ + 2I- ® PbI2¯
желтый желтый
12. Ag+ + Cl- ® AgCl¯
4[Ag(NH3)2]OH + HCOH 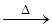 4Ag¯ + (NH4)2CO3 + 6NH3 + 2H2O
4Ag¯ + (NH4)2CO3 + 6NH3 + 2H2O
13. 2Sb3 + 3Na2S ® Sb2S3¯ + 6Na+
оранжевый
14. Zn2+ + 2OH- ® Zn(OH)2¯
белый
Zn(OH)2¯ + 2OH- ® [Zn(OH)4]2-
Zn(OH)2 ¯+ 4NH3 ® [Zn(NH3)4]2+ + 2OH-
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 3618; Нарушение авторских прав?; Мы поможем в написании вашей работы!