
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газовые смеси
|
|
|
|
З 2.6
З-2.5
З-2.4
З-2.3
З-2.2
З-2.1
Задачи
Решение.
П-2.2
Решение.
П-2.1
Примеры
Баллон с кислородом емкостью 20 л находится под давлением
10 МПа при 15 ºС. После израсходования части кислорода давление понизилось до 7,6 МПа, а температура упала до 10 ºС.
Определить массу израсходованного кислорода.
Из характеристического уравнения (2.5)
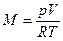
Следовательно, до расходования кислорода масса его состояла
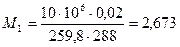 кг,
кг,
а после израсходования
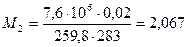 кг.
кг.
Таким образом, расход кислорода
ΔМ = М1 –М2 = 2,673 - 2,067 = 0,606 кг.
Определить плотность и удельный объем окиси углерода СО при давлении 0,1 МПа при температуре 27 ºС.
Удельный объем определяется из характеристического уравнения (2.6)
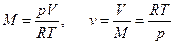
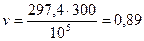 м3/кг.
м3/кг.
Плотность окиси углерода (1.2)
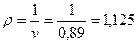 кг/м3.
кг/м3.
В цилиндре с подвижным поршнем находится кислород при
t = 80 ºС и разряжении (вакууме), равном 427 гПа. При постоянной температуре кислород сжимается до избыточного давления
pизб = 1,2 МПа. Барометрическое давление В = 933 гПа.
Во сколько раз уменьшится объем кислорода?
Ответ: V1/V2 = 22,96.
В комнате площадью 35 м2 и высотой 3,1 м воздух находится при t = 23 ºС и барометрическом давлении В = 973 гПа.
Какое количество воздуха проникнет с улицы в комнату, если барометрическое давление увеличится до В = 1013 гПа. Температура воздуха остается постоянной.
Ответ:  М = 5,1 кг.
М = 5,1 кг.
В сосуде объемом 5 м3 находится воздух при барометрическом давлении В = 0,1 МПа и температуре 300 ºС. Затем воздух выкачивается до тех пор, пока в сосуде не образуется вакуумметрическое давление, равное 80 кПа. Температура воздуха после выкачивания остается той же.
Сколько воздуха выкачано? Чему будет равно давление в сосуде после выкачивания, если оставшийся воздух охладить до температуры t = 20 ºС?
|
|
|
Ответ: выкачано 2,43 кг воздуха. После охлаждения воздуха давление будет равным 10,3 кПа.
В воздухоподогреватель парового котла подается вентилятором 130000 м3/ч воздуха при температуре 30 ºС.
Определить объемный расход воздуха на выходе из воздухоподогревателя, если он нагревается до 400 ºС при постоянном давлении.
Ответ: V = 288700 м3/ч.
Во сколько раз изменится плотность газа в сосуде, если при постоянной температуре показание манометра уменьшится от р1 = 1,8 МПа до р2 = 0,3 МПа?
Барометрическое давление принять равным 0,1 МПа.
Ответ: 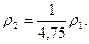
В сосуде объемом 0,5 м3 находится воздух при давлении 0,2 МПа и температуру 20 ºС.
Сколько воздуха надо выкачать из сосуда, чтобы разрежение в нем составило 56 кПа при условии, что температура в сосуде не изменится? Атмосферное давление по ртутному барометру равно 102,4 кПа при температуре ртути в нем, равной 18 ºС. Разрежение в сосуде измерено ртутным вакуумметром при температуре ртути 20 ºС.
Ответ: М = 1,527 кг.
Часто приходится решать задачи, в которых рассматриваются не отдельные газы, а их смеси. При смешении химически невзаимодействующих газов, имеющих различные давления и температуры, обычно приходится определять конечное состояние смеси. При этом различают два случая (таблица 1).
Таблица 1
Смешение газов*
| Температура, К | Давление, Па | Объем, м3 (объемный расход, м3/ч) | |
| Смешение газов при V=const | 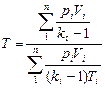
| 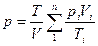
| 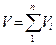
|
| Смешение газовых потоков** | 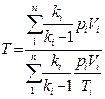
| 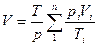
| |
| * - все уравнения, относящиеся к смешению газов, выведены при условии отсутствия теплообмена с окружающей средой; ** - если массовые расходы (М1, М2, …Мn, кг/ч) смешивающихся потоков равны. |
Здесь ki – отношение теплоемкостей газов (см.формулу (4.2)).
Под газовыми смесями понимают механическую смесь нескольких газов, химически между собой не взаимодействующих. Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми mi или объемными ri долями:
|
|
|
mi = Mi / M; ri = Vi / V, (3.1)
где Mi – масса i -го компонента,
Vi – парциальный или приведенный объем i- го компонента;
M, V – масса и объем всей смеси соответственно.
Очевидно, что
М1 + М2 +…+Мn = M; m1 + m2 +…+mn = 1, (3.2)
а также
V1 + V2 +…+ Vn = V; r1 + r2 +…+rn = 1, (3.3)
Связь между давлением газовой смеси р и парциальным давлением отдельных компонентов рi, входящих в смесь, устанавливается законом Дальтона
р = Sрi, (3.4)
Если заданы состав газовой смеси, а также характеристики составляющих смесь газов, то можно рассчитать необходимые характеристики смеси по приводимым в таблице 2 формулам.
Таблица 2
Формулы для расчета газовых смесей
| Задание состава смеси | Перевод из одного состава в другой | Плотность и удельный объем смеси | Кажущаяся молекулярная масса смеси | Газовая постоянная смеси, Дж/(кг×К) | Парциальное давление |
| Массовыми долями | 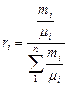
| 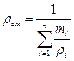
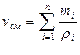
| 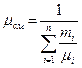
| 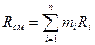
| 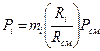
|
| Объемными долями | 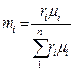
| 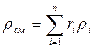
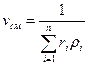
| 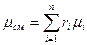
| 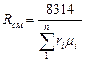
| 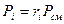
|
В таблице 2 mi – молекулярная масса i -го компонента;
8314 Дж/(кмоль×К) – значение универсальной газовой постоянной;
Ri – газовая постоянная i -го компонента.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 5698; Нарушение авторских прав?; Мы поможем в написании вашей работы!