
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики
|
|
|
|
З-4.5
З-4.4
З-4.3
З-4.2
З-4.1
Задачи
Решение.
П-4.2
Решение.
П-4.1
Примеры
Вычислить среднюю массовую и среднюю объемную теплоемкости окиси углерода при постоянном объеме для интервала температур 0-1200 ºС, если известно, что для окиси углерода
(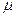 срm) 01200=32,192 кДж/(кмоль·К).
срm) 01200=32,192 кДж/(кмоль·К).
Сопоставить полученные результаты с табличными данными.
 кДж/(м3·К);
кДж/(м3·К);
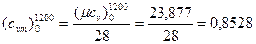 кДж/(м3·К);
кДж/(м3·К);
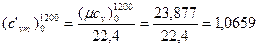 кДж/(м3·К).
кДж/(м3·К).
Из приложения Д
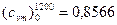 кДж/(м3·К);
кДж/(м3·К);
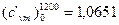 кДж/(м3·К).
кДж/(м3·К).
Воздух в количестве 6 м3 при давлении р1 = 0,3 МПа и температуре t1 = 25 ºС нагревается при постоянном давлении до t2 = 130 ºС.
Определить количество подведенной к воздуху теплоты, считая
с = const.
Для данного случая формула (4.5) примет вид:
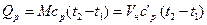 .
.
Массу газа найдем из уравнения
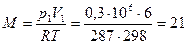 кг,
кг,
а объем газа при нормальных условиях – из уравнения
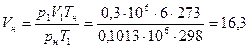 нм3.
нм3.
На основании формул (4.1) имеем
 кДж/(кг·К);
кДж/(кг·К);
 кДж/(нм3·К).
кДж/(нм3·К).
Следовательно,
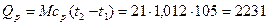 кДж,
кДж,
или
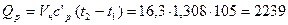 кДж.
кДж.
Баллон с водородом выносится из помещения с температурой 5 ºС в машинный зал, где температура достигает 25 ºС.
Определить количество теплоты, полученной газом после выравнивания температуры, если начальное давление в баллоне составляло 12 МПа. Объем баллона 40 дм3.
Ответ: Qv = 84 кДж.
Воздух выходит из компрессора при p1 = 0,7 МПа и t2 = 160 ºС и поступает в холодильник. На выходе из холодильника температура воздуха равна 25 ºС.
Определить количество теплоты, отданной охлаждающей воде в течение часа, если производительность компрессора V = 6 м3/мин.
Ответ: Q = 275435 кДж/ч.
В регенеративном подогревателе газовой турбины воздух нагревается при постоянном давлении от t1 =130 ºС до t2 =500 ºС.
Определить количество теплоты, сообщенной воздуху в единицу времени, если расход его составляет 250 кг/ч. Ответ дать в килоджоулях в секунду и в киловаттах. Для решения воспользоваться таблицами.
|
|
|
Ответ: Q =27 кДж/с=27 кВт.
Используя таблицу 3, найти объемную теплоемкость кислорода при постоянном объеме и постоянном давлении, считая с = const.
Ответ:  кДж/(м3·К);
кДж/(м3·К); 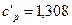 кДж/(м3·К).
кДж/(м3·К).
Определить значение массовой теплоемкости кислорода при постоянном объеме и постоянном давлении, считая с = const.
Ответ: сp = 0,916 кДж/(кг·К); сv = 0,654 кДж/(кг·К).
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии. Он устанавливает эквивалентность при взаимных превращениях механической и тепловой энергии и математически может быть выражен следующим образом:
Q = L, (5.1)
где Q – количество теплоты, превращенной в энергии, Дж;
L – работа, полученная за счет теплоты Q, Дж.
Аналитическое выражение первого закона термодинамики или основное уравнение теплоты в дифференциальной форме для любого тела
dQ = dU + dL, (5.2)
где dQ – количество теплоты, сообщенное извне рабочему телу массой М кг;
dU – изменение внутренней энергии рабочего тела;
dL – работа, совершенная рабочим телом по преодолению внешнего давления.
Каждый из трех членов этого уравнения может быть в зависимости от характера изменения состояния положительным, отрицательным или равным нулю. Для бесконечно малого изменения состояния
1 кг любого газа уравнение (5.2) примет вид:
dq = du + dl. (5.3)
Так как
dа = pdv,
то
dq = du + pdv. (5.4)
Для конечного изменения состояния уравнения (5.2) и (5.3) примут вид
Q = ΔU + L, (5.5)
q = Δu + l. (5.6)
Работа расширения 1 кг газа
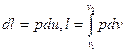 , (5.7)
, (5.7)
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1кг)
du = cvdt. (5.8)
В теплотехнических расчетах обычно требуется знать изменение внутренней энергии Δu, а не ее абсолютное значение. Интегрируя уравнение (5.8) в пределах от t1 до t2, получаем
Δu = cvm(t2 - t1), (5.9)
|
|
|
где cvm – средняя массовая теплоемкость при постоянном объеме в пределах от t1 до t2.
Заменяя в уравнении (5.4) величину pdv через (d(pv) – vdp) получаем
dq = du + d(pv) – vdp = d(u + pv) – vdp.
Выражение u + pv является параметром состояния. В технической термодинамике этот параметр называется энтальпия и обозначается буквой i. Таким образом
i = u + pv, (5.10)
следовательно, основное уравнение первого закона термодинамики, выраженное через энтальпию, имеет вид
dq = di – vdp. (5.11)
Так как для идеальных газов di = cd ·dT, то
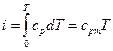 , (5.12)
, (5.12)
где cрm – средняя массовая теплоемкость при постоянном давлении в пределах от 0º до Т.
В теплотехнических расчетах обычно требуется знать изменение энтальпии, а не ее абсолютное значение. Интегрируя уравнение (5.11) при p = const, получаем
qp = i2 – i1. (5.13)
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 7677; Нарушение авторских прав?; Мы поможем в написании вашей работы!