
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы. Уравнение Ван-дер-Ваальса
По мере увеличения плотности газа его свойства все более отклоняются от свойств идеального газа и, в конце концов, наступает его конденсация в жидкость. Эти явления связаны со сложными молекулярными взаимодействиями, и нет способа, которым можно было бы учесть эти взаимодействия количественным образом, с тем, чтобы теоретически построить точное уравнение состояния вещества.
Можно, однако, построить уравнение состояния, учитывающее основные качественные особенности молекулярного взаимодействия.
Характер взаимодействия молекул. Быстро возрастающие на малых расстояниях силы отталкивания. Их наличие означает, грубо говоря, что молекулы занимают некоторый определенный объем, дальше которого газ не может быть сжат. Другое основное свойство взаимодействия заключается в притяжении на больших расстояниях. Это притяжение очень существенно, поскольку именно оно приводит к конденсации газа в жидкость. Эти моменты можно учесть в уравнении состояния (для одного моля вещества).
Учет ограниченной сжимаемости газа. Для этого надо в уравнении идеального газа p = RT/V заменить объем V разностью V–b, где b – некоторая положительная постоянная, учитывающая размеры молекул. Уравнение
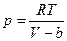
показывает, что объем не может быть сделан меньшим, чем b, поскольку при V = b давление обращается в бесконечность,
Учет притяжения молекул. Это притяжение должно приводить к уменьшению давления газа, поскольку на каждую молекулу, находящуюся вблизи стенки сосуда, будет действовать со стороны остальных молекул сила, направленная внутрь сосуда. В грубом приближении эта сила пропорциональна числу молекул в единице объема, т. е. плотности газа. С другой стороны, давление само пропорционально этому же числу. Поэтому общее уменьшение давления, связанное с взаимным притяжением молекул, пропорционально квадрату плотности газа, т. е. обратно пропорционально квадрату его объема. В соответствии с этим давление уменьшается на величину a / V 2, где а – некоторая новая постоянная, характеризующая силы молекулярного притяжения. Таким образом, новое уравнение имеет вид
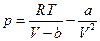
или, иначе,
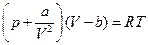
Это – так называемое уравнение Ван-дер-Ваальса. При большом разрежении газа (большие объемы V) величинами а и b можно пренебречь, и выражение сводится к уравнению состояния идеального газа. Это же уравнение правильно описывает характер явлений и в обратном предельном случае больших сжатий.
Исследовать поведение газа, описываемого уравнением Ван-дер-Ваальса, путем анализа изотермы – кривой зависимости р от V при заданных значениях Т. Уравнение Ван-дер-Ваальса можно переписать в виде
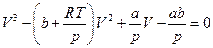
При заданных значениях р и Т это – уравнение третьей степени относительно неизвестного V. Как известно, уравнение третьей степени имеет три корня, из которых вещественными могут быть либо все три, либо один (в последнем случае уравнение имеет также два комплексно сопряженных корня).
Физическим смыслом объема могут обладать, разумеется, лишь вещественные (причем положительные) корни. В данном случае уравнение вообще не может иметь (при положительных давлениях р) отрицательных корней – при отрицательном V все члены уравнения имели бы одинаковый (отрицательный) знак и давали бы в сумме нуль.
|
Поэтому заданным значениям температуры и давления по уравнению Ван-дер-Ваальса соответствуют либо три различных, либо одно значение объема.
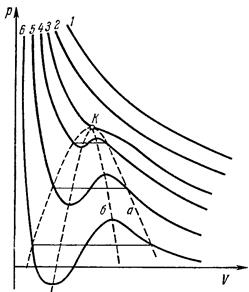
Второй случай всегда имеет место при достаточно высоких температурах. Соответствующие изотермы отличаются от изотерм идеального газа лишь некоторым искажением их формы, но остаются монотонно спадающими кривыми (кривые 1, 2 на рис. 7; увеличение номера кривых соответствует убыванию температуры). При более же низких температурах изотермы имеют максимум и минимум (кривые 3, 4, 5, 6), так что для каждой из них существуют такие интервалы давлений, в которых кривая определяет три различных значения V (три точки пересечения изотермы с горизонтальной прямой).
|
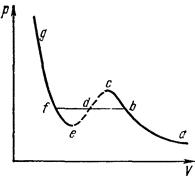
На рис. 8 изображена одна из таких изотерм. Следует выяснить, какой смысл имеют различные ее участки. На участках ge и са зависимость давления от объема имеет нормальный характер – давление возрастает при уменьшении объема. Участок же се соответствовал бы неестественному положению, когда сжатие вещества приводило бы к уменьшению давления. Однако, такие состояния вообще не могут осуществляться в природе. Действительно, пусть существует вещество с такими свойствами и пусть какой-либо маленький участок его случайно сжался, хотя бы в результате флуктуации. Тогда его давление тоже уменьшится, т. е. станет меньше давления окружающей среды, что в свою очередь вызовет дальнейшее сжатие и т. д., т. е. данный маленький участок будет продолжать сжиматься с возрастающей скоростью. Это значит, что рассматриваемые состояния вещества были бы совершенно неустойчивыми и потому не могут быть осуществлены в действительности.
Наличие заведомо неосуществимого участка ее изотермы означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды. В некотором диапазоне объемов должно наступить скачкообразное изменение состояния, то есть распадение вещества на две фазы. Другими словами, истинная изотерма будет иметь вид ломаной линии аbfg. Часть ее ab отвечает газообразному состоянию вещества, а часть fg – жидкому состоянию. Горизонтальный же прямолинейный отрезок bf соответствует двухфазным состояниям – переходу газа в жидкость, происходящему (при заданной температуре) при определенном постоянном давлении.
Что касается участков изотермы bс и ef, то они отвечают так называемым метастабильным состояниям – переохлажденному пару и перегретой жидкости. Теперь видно, что существуют определенные границы (изображаемые точками с и е), дальше которых переохлаждение пара или перегрев жидкости вообще невозможны. При повышении температуры прямолинейный участок изотермы уменьшается и при критической температуре стягивается в одну точку (точка К на рис. 7). Проходящая через эту точку изотерма 3 разделяет изотермы обоих типов: монотонные изотермы 1, 2 и изотермы 4, 5, 6 с минимумами и максимумами, на которых неизбежно распадение вещества на две фазы.
Если соединить между собой точки начала и конца прямолинейных отрезков изотерм (кривая а на рис. 7), то получающаяся кривая представит собой кривую фазового равновесия жидкости и пара на диаграмме р, V. Максимум К этой кривой есть критическая точка. Соединение точек, подобных точкам с и е на рис. 8, дает кривую (кривая б на рис. 7), ограничивающую область, в которой неразделенное на фазы вещество не может существовать даже в метастабильном состоянии.
В критической точке сливаются в одну три точки, в которых прямолинейный участок пересекает изотерму Ван-дер-Ваальса. Отсюда следует, что касательная к изотерме в критической точке имеет горизонтальное направление, т. е. обращается в нуль производная от давления по объему (при постоянной температуре)
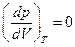
Величина, обратная этой производной, есть сжимаемость вещества. Таким образом, в критической точке сжимаемость вещества обращается в бесконечность, что вполне соответствует представлениям об исключительно малой сжимаемости жидкостей.
|
|
Дата добавления: 2015-05-09; Просмотров: 872; Нарушение авторских прав?; Мы поможем в написании вашей работы!