
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические состояния и термодинамические процессы
|
|
|
|
Физика макросистем
Лекция 10
ФИЗИЧЕСКАЯ ТЕРМОДИНАМИКА
Макросистемой называют систему, имеющую массу, сравнимую с массой окружающих нас тел и состоящую из очень большого числа микрочастиц (атомов и молекул). Например, в одном моле вещества содержится N A = 6,02.1023 молекул, а масса одного моля воздуха всего 29 грамм при объёме 22,4 литра при нормальных условиях.
Для описания макросистем используют два метода: статистический и термодинамический. В дальнейшем вместо термина макросистема иногда будем использовать термин термодинамическая система.
Статистический метод основывается на применении законов теории вероятностей для получения функции распределения физической величины. Данный метод включает в себя:
А). статистическую физику равновесных состояний (для описания состояния макросистемы, если функция распределения не зависит от времени);
Б ). кинетическое описание макросистемы, позволяющее получить на основе уравнений динамики микрочастиц решения для целого ряда практически важных задач для процессов в газе, плазме и различных конденсированных средах, а также описывать необратимые процессы;
В). г идродинамическое описание макросистемы, позволяющее составить уравнения для средних значений динамических параметров среды (скорости течения, температуры, плотности и т.д.). В эти уравнения входят коэффициенты переноса (вязкости, теплопроводности, диффузии).
Термодинамический метод заключается в описании поведения систем с помощью основных постулатов (начал термодинамики), справедливость которых подтверждается только опытным путём. Данный метод включает в себя:
А). равновесную термодинамику, которая достаточно точно описывает большинство окружающих нас термодинамических систем и существующих тепловых машин;
|
|
|
Б). термодинамику необратимых процессов, которая описывает системы в состояниях, заметно отличающихся от равновесного.
Термодинамический и статистический методы изучения макросистем дополняют друг друга. Термодинамика позволяет изучать явления без знания их внутренних механизмов, а статистический метод позволяет понять суть явлений, установить связь поведения системы в целом с поведением и свойствами отдельных частиц.
Равновесным называется такое состояние термодинамической системы, в котором отсутствуют потоки энергии, вещества, импульса, а макроскопические параметры системы являются установившимися и не меняются во времени.
Нулевое начало термодинамики: изолированная система стремится к состоянию термодинамического равновесия и после его достижения не может самопроизвольно из него выйти.
Равновесные состояния обладают следующими свойствами:
1) если две термодинамические системы, имеющие тепловой контакт, находятся в состоянии термодинамического равновесия, то и общая система, состоящая из этих двух, находится в состоянии термодинамического равновесия;
2) если какая-либо термодинамическая система находится в термодинамическом равновесии с двумя другими системами, то и эти две системы находятся в термодинамическом равновесии друг с другом.
Величиной, характеризующей состояние термодинамического равновесия макросистемы, является температура. Если при установлении теплового контакта между телами одно из тел передаёт энергию другому посредством теплопередачи, то считают, что первое тело имеет большую температуру, чем второе.
Состояние макросистемы характеризуют величинами, которые называют термодинамическими параметрами (давление р, объём V, температура Т, концентрация п и др.).
|
|
|
Равновесное состояние можно представить точкой в пространстве, по координатным осям которого откладываются значения параметров состояния.
Переход из одного термодинамического состояния в другое называется термодинамическим процессом.
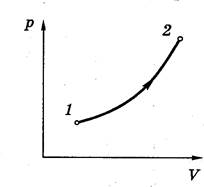 Равновесным или квазистатическим процессом называют процесс, проходящий достаточно медленно и состоящий из непрерывно следующих одно за другим состояний термодинамического равновесия. Он может быть изображён, например, на диаграмме p,V соответствующей кривой.
Равновесным или квазистатическим процессом называют процесс, проходящий достаточно медленно и состоящий из непрерывно следующих одно за другим состояний термодинамического равновесия. Он может быть изображён, например, на диаграмме p,V соответствующей кривой.
Неравновесные процессы условно изображают пунктирными кривыми.
Равновесный процесс может быть проведён в обратном направлении через ту же совокупность равновесных состояний, т.е. по той же кривой  , но в обратном направлении
, но в обратном направлении  . По этой причине равновесные процессы называют обратимыми.
. По этой причине равновесные процессы называют обратимыми.
Круговым или циклическим называют процесс, в ходе которого система возвращается в исходное состояние. Круговые термодинамические процессы могут быть как равновесными (обратимыми) так и неравновесными (необратимыми). При равновесном круговом процессе, после возвращения системы в исходное состояние, в окружающих её телах не возникает никаких термодинамических возмущений и их состояния остаются равновесными (внешние параметры системы после осуществления циклического процесса возвращаются к своим исходным состояниям)
Внутренняя энергия термодинамической системы.
Внутренней энергией U макросистемы называют величину, состоящую из:
1) суммарной кинетической энергии хаотического движения молекул в Ц-системе, связанной с самой системой, в которой суммарный импульс всех молекул равен нулю;
2) собственной потенциальной энергии взаимодействия всех молекул, т.е. энергии взаимодействия только между молекулами, принадлежащими данной системе;
3) внутренней энергии самих молекул, атомов и ядер.
В термодинамике внутреннюю энергию определяют с точностью до некоторой постоянной. Определяющим в термодинамике является изменение внутренней энергии системы Δ U.
Наиболее существенное отличие внутренней энергии U в том, что она является функцией состояния и не зависит от того, каким путём система приведена в данное состояние. Изменение внутренней энергии определяется только конечным и начальным состояниями и не зависит от процесса, который перевёл систему из одного состояния в другое.
|
|
|
Если макросистема состоит из нескольких частей, то внутренняя энергия всей системы равна практически сумме внутренних энергий её частей.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 913; Нарушение авторских прав?; Мы поможем в написании вашей работы!