
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные характеристики элементов
|
|
|
|
Н Н
 Н
Н
|
 Н Н Н
Н Н Н

Н
 Н
Н
Н
Рис. 2. Образование водородных связей.
В структуре жидкой воды сохраняется тетраэдрическая координация, присущая кристаллической структуре льда. Сохранение льдоподобного каркаса связей между молекулами в структуре жидкой воды образует каналообразные пустоты, заполненные мономерными молекулами. Доля мономерных молекул возрастает с повышением температуры.
Особенности структуры жидкой воды определяют её аномальные физико-химические свойства: высокую теплоёмкость, высокие температуры кипения и плавления, аномальную плотность и увеличение объёма при кристаллизации способность растворять многие, в том числе неполярные, вещества.
Третье уникальное свойство молекул воды – способность образовывать донорно-акцепторные связи за счёт неподелённых электронных пар кислорода и образовывать аквакомплексы. Самодиссоциация жидкой воды осуществляется по схеме:
2Н2О ↔ Н3О+ + ОН– , Кд = 1,8·10 -16
Важной количественной характеристикой является ионное произведение воды, которое для выражения концентраций в моль/дм3 при Т = 298 К равно [H+][OH-] = Кд·с(Н2О) = Kw; Kw = 1,0·10-14 и величина которого при повышении температуры возрастает.
Химические свойства воды:
1. Взаимодействие с металлами: активными – непосредственно,
Са(т) + 2Н2О(ж) →Са(ОН)2(в) + Н2(г);
средней активности – при нагревании,
2Fe(т) + 3 Н2О(г)↔ Fe2O3(т) + 3Н2(г)
2. Взаимодействие с неметаллами:
Cl2(г) + Н2О(ж) ↔HCl(в) + HClO(в)
3. С оксидами: СаО(т) + Н2О(ж) → Са(ОН)2(в)
Р2О5(т) + Н2О(ж) →2Н3РО4(в);
4. С солями – гидролиз, образование аквакомплексов, кристаллогидратов:
Na2CO3(в) + Н2О(ж) ↔ NaHCO3(в) + NaOH(в)
CoCl2(в) + 6Н2О(ж) →[Co(H2O)6]Cl2(в)
CuSO4(в) + 5Н2О(ж) → CuSO4 ּ 5Н2О(т)
|
|
|
5. С органическими соединениями – гидратация:
С2Н4(г) + Н2О(ж)→С2Н5ОН(в)
Вода, входящая в состав гидроксидов, кислых и основных солей называется конституционной (химически связанной). Выделить её из соединения можно разложением вещества при высоких температурах.
Вода, присоединённая по координационному типу во внутренней сфере комплексных соединений или кристаллогидратов называется кристаллизационной.
Кристаллизационная вода легко выветривается, поэтому фармпрепараты, содержащие кристаллизационную воду следует хранить в плотно укупоренной таре.
Некоторые безводные соли – CaCl2, K2CO3, Mg(ClO4)2 легко поглощают влагу, их используют в качестве осушителей для воды, называемой гигроскопической и адсорбированной поверхностью сыпучих, порошкообразных веществ.
Вода дистиллированная используется для приготовления лекарств и растворов для инъекций.
Пероксид водорода (Н2О2) образуется при гидролизе дисерной (надсерной) кислоты:
Н2S2O8(в) + Н2О(ж) → Н2SO4(в) + Н2О2(в);
или при действии разбавленной серной кислоты на пероксид бария:
Н2SO4(в) + ВаО2(в) → ВаSO4(т) + Н2О2(в);
В промышленности пероксид водорода получают в 2-е стадии из антрахинона. Строение молекулы Н2О2 показано на рисунке 3:
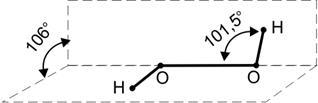
Рис. 3. Структура молекулы Н2О2. В газовой фазе длина связи О-О
равна 147 пм, угол О-О-Н составляет 950; угол 900 – торсионный угол межд
у
плоскостями в твёрдой молекуле (в газовой фазе – 1110)
Пероксид водорода – голубоватая вязкая жидкость с Тпл = 272 К, Ткип = = 425 К и плотностью r298 = 1,46 г/см3. Смешивается с водой в любых соотношениях.
Водный раствор с массовой долей 31 % называется пергидролем.
Пероксид водорода термодинамически нестабилен и имеет тенденцию к разложению на воду и кислород по реакции диспропорционирования:
2Н2О2(в) →2Н2О(ж) + О2(г) D.rH0298 = -196 кДж
Разложение Н2О2 ускоряют свет, нагревание, присутствие катализаторов – MnO2, OH-, поверхность некоторых металлов. Кровь также является катализатором этой реакции, что позволяет использовать Н2О2 как антисептик – выделяющийся кислород убивает анаэробные бактерии.
|
|
|
Водный раствор Н2О2 является слабой двухосновной кислотой:
Н2О2 + Н2О(ж) ↔ Н3О + + НО2-, К1=1,78·10-12
(гидропероксид – ион) НО2-↔ Н+ + О22-,
Кислые (NaНО2) и средние (Na2О2) соли называются пероксидами.
Степень окисления кислорода в пероксиде водорода -1, поэтому он проявляет окислительно-восстановительную двойственность:
1. 2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2H2O
окислитель Н2О2 + 2е + 2Н+ → 2 Н2О – восстановление
2. 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
восстановитель Н2О2 - 2е →2Н++ О2 – окисление
Окислительные свойства выражены сильнее, поэтому пероксид водорода находит своё применение как окислитель при отбеливании тканей, в медицине как антисептик, проявляется в процессах метаболизма, как источник кислорода для биохимических процессов. Он проявляет вяжущее и кровоостанавливающее свойства, применяется в качестве дезодорирующего и депигментирующего средства. 3% раствор применяется наружно в качестве дезинфицирующего средства.
s- ЭЛЕМЕНТЫ
Внешнее электронное строение s- элементов 1А группы – ns1; IIA группы – ns2, степени окисления +1 и +2, соответственно.
В направлении от Li до Fr и от Be до Ra радиусы атомов увеличиваются, потенциалы ионизации и электроотрицательность уменьшаются, химическая активность (способность отдавать электроны) возрастает.
Простые вещества элементов 1А группы (Li, Na, K, Rb, Cs, Fr) – щелочные металлы; элементов IIA группы (Be, Mg, Ca, Sr, Ba, Ra) – щелочноземельные металлы (кроме Be и Mg); они серебристо – белого цвета (кроме Cs, жёлтого цвета), мягкие и пластичные, лёгкие, низкоплавкие с хорошей электропроводимостью (табл. 1).
Вследствие высокой реакционной способности в природе в свободном виде эти металлы не встречаются. Самым распространённым элементом 1А группы в земной коре являются натрий (2,6 %) и калий (2,5 %),
IIA группы – кальций (3,5 %), в живых организмах – 0,1 %, 0,27 % и 1,9 %, соответственно. Основные физико-химические свойства металлов представлены в табл. 2.
Получают s-элементы электролизом расплавов галогенидов или гидроксидов, реже – металлотермическим или термическим разложением соединений.
|
|
|
Таблица 1
| Элемент | Li | Na | K | Rb | Cs | Fr |
| Атомный номер | ||||||
| Ковалентный радиус, нм | 0,123 | 0,154 | 0,203 | 0,216 | 0,235 | – |
| Металлический радиус, нм | 0,155 | 0,190 | 0,235 | 0,248 | 0,267 | 0,280 |
| Радиус иона Э+, нм | 0,076 | 0,102 | 0,138 | 0,152 | 0,167 | 0,175 |
| Электроотрицательность | 0,97 | 1,01 | 0,91 | 0,89 | 0,86 | 0,86 |
| Первый потенциал ионизации, В | 5,392 | 5,139 | 4,341 | 4,177 | 3,894 | 3,98 |
Таблица 2
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1126; Нарушение авторских прав?; Мы поможем в написании вашей работы!