
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Исходные данные. Индивидуальные задания
|
|
|
|
Индивидуальные задания
Контрольные вопросы и задания
1. Строение атомов элементов подгруппы хрома и их ионов в разных валентных состояниях.
2. Общая характеристика элементов VIВ группы.
3. Возможные степени окисления хрома показать графически.
4. Химические свойства хрома.
5. Свойства соединений двухвалентного хрома.
6. Соединения хрома (III).
7. Амфотерность оксида и гидроксида хрома (III) докажите с помощью уравнений реакций.
8. Гидролиз солей хрома (III).
9. Соединения хрома (VI). Окислительные свойства и зависимость их от рН.
10. Состояние хромат- и дихромат-ионов в растворе.
11. Изополисоединения хрома.
12. Пероксидные соединения хрома.
13. Характер изменения кислотно-основных и окислительно-восстановительных свойств соединений хрома при переходе от низших степеней окисления к высшим.
14. Биологическое значение хрома и молибдена и их соединений.
15. Химические основы применения соединений хрома и молибдена в фармацевтическом анализе.
16. Строение атомов элементов подгруппы марганца.
17. Общая характеристика элементов VIIB группы.
18. Химические свойства марганца.
19. Возможные степени окисления марганца.
20. Химический характер оксидов и гидроксидов марганца.
21. Свойства солей двухвалентного марганца (растворимость, гидролизуемость).
22. Комплексные соединения двух- и трёхвалентного марганца.
23. Диоксид марганца, его кислотно-основные и окислительно-восстановительные свойства.
24. Соединения шестивалентного марганца – получение, термическая устойчивость, поведение в водных растворах, условия стабилизации.
25. Оксид и гидроксид семивалентного марганца. Перманганаты, их окислительная способность в разных средах.
|
|
|
26. Применение перманганата калия в медицине и фармацевтическом анализе.
Задание. Решите задачи своего варианта (табл. 13).
Таблица 13
| Вариант | Номера задач | ||||||
| 14вг | 80г | ||||||
| 14аб | 80в | ||||||
| 37де | 80б | ||||||
| 37вг | 80а | ||||||
| 37аб | |||||||
| 36в | |||||||
| 36б | |||||||
| 36а | |||||||
| 37жз | |||||||
| 81еж | |||||||
| 81де | |||||||
| 81вг | |||||||
| 81аб | |||||||
| 80д | |||||||
| 14де |
1. Укажите различия в строении атомов элементов VIA и VIB групп. Как это отражается на их свойствах?
2. Какие степени окисления проявляют хром, молибден, вольфрам?
Составьте формулы соединений с характерными степенями окисления, назовите их.
3. Каков химический характер оксидов и гидроксидов двух-, трёх-, и шестивалентного хрома? Подтвердите соответствующими уравнениями реакций.
4. Составьте схемы диссоциации гидроксидов двух-, трёх-, и шестивалентного хрома.
5. Подтвердите уравнениями реакций в молекулярной и ионной форме химический характер гидроксида трёхвалентного хрома.
6. Какие координационные числа характерны для 2 и 3-валентного хрома?
7. В каких формах ион трёхвалентного хрома существует в нейтральных, кислых и щелочных растворах?
8. Какие степени окисления и координационные числа характерны для хрома – комплексообразователя? Приведите примеры комплексных соединений хрома.
9. Приведите способы получения солей хрома (III).
10. Составьте уравнение реакции получения Cr2О3 термическим разложением дихромата аммония. Какова роль энтальпийного и энтропийного факторов в протекании этого процесса и является ли процесс обратимым?
|
|
|
11. Какие условия способствуют полимеризации хромат(VI) – иона в водном растворе?
12. В каком направлении сместится равновесие:
2CrO42– + 2H+ ↔ Cr2O72– + H2O
при добавлении а) кислоты; б) щёлочи; в) соли бария? Ответ обоснуйте.
13. Какие свойства проявляют соединения хрома (III) и хрома (VI) в окислительно-восстановительных реакциях? Как влияет среда на эти процессы? Приведите соответствующие уравнения реакций и уравняйте их ионно-электронным методом.
14. Составьте полные уравнения реакций и уравняйте их ионно-электронным методом:
а. Cr2(SO4)3(в) + PbO2(т) + KOH(в) ®
б. CrCl3(в) + Na2O2(в) + NaOH(в) ®
в. К2Cr2O7(в) + K2S(в) + H2SO4 (в) ®
г. К2Cr2O7(в) + FeSO4(в) + H2SO4(в) ®
д. К2Cr2O7(в) + Zn(т) + H2SO4(в) ®
е. Na2CrO4(в) + NaI(в) + H2SO4(в) ®
15. Как изменяется химическая активность металлов в ряду Cr – Mo – W? Ответ обоснуйте и проиллюстрируйте соответствующими уравнениями реакций.
16. Какая из кислот является более сильной – хромовая или молибденовая? Ответ мотивируйте.
17. Определите степени окисления хрома, молибдена и вольфрама в следующих соединениях:
(NH4)2WO4, FeCrO4, MoO2Cl2, WS3∙KCr(SO4)2∙12H2O.
18. Составьте координационные формулы соединений следующего состава и назовите их: CrCl3∙5H2O; 3KCN∙Cr(CN)3.
19. Определите заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: [Cr(H2O)4PO4]; H3[Cr(SO4)3]; K[CrO3Cl]]; [Cr(OH)(H2O)5]Cl2; K2[MoO2F4]; K3[WO3F3]
20. Вычислите изменение энергии Гиббса в реакциях термического разложения CrО3∙, MoO3, WO3 при стандартных условиях. Каким образом меняется термическая устойчивость этих оксидов в ряду?
21. Определите массовую долю дихромата натрия в продукте, если 1,0 г его полностью окисляет в кислой среде 3,38 г иодида калия.
22. При сплавлении 6,08 г оксида хрома (III) с окислителем в присутствии щёлочи получено 12,74 хромата натрия определите выход продукта в процентах.
23. Составьте электронную и электронно-графическую формулы марганца. Покажите все возможные степени окисления. Какова его высшая степень окисления?
24. Напишите формулы всех оксидов марганца и соответствующих им гидроксидов. Как меняется химический характер оксидов и гидроксидов с увеличением степени окисления? Ответ подтвердите уравнениями реакций.
25. Опишите свойства оксида и гидроксида марганца (II) и подтвердите их уравнениями реакций. Как получить Mn(OH)2?
|
|
|
26. Опишите свойства солей марганца (II), их растворимость и гидролиз.
27. Как получить сульфат марганца (II) из оксида марганца (IV), из металлического марганца, из перманганата калия?
28. Опишите свойства соединений марганца (IV).
29. Какое соединение марганца наиболее распространено в природе? Как получить его, исходя из MnCl2, из KMnO4?
30. Как получают соединения марганца (VI)? Напишите уравнения реакций. Какова устойчивость этих соединений и свойства?
31. Какие процессы происходят при взаимодействии манганата (VI) калия с водой? Какова устойчивость соответствующей кислоты? Подберите коэффициенты в уравнениях реакций ионно-электронным методом, обозначив состояния веществ:
K2MnO4 + H2O ® H2MnO4 + KOH
H2MnO4 ® HMnO4 + MnO2 + H2O
Как повысить устойчивость растворов манганатов?
32. Опишите свойства перманганата калия.
33. Опишите свойства соединений марганца (VII).
34. Напишите уравнения реакций взаимодействия KMnO4 с нитратом натрия в кислой, нейтральной и щелочной средах. Определите эквивалент и молярную массу эквивалента перманганата калия в этих средах. От каких факторов зависит состав продуктов восстановления?
35. Какие из соединений марганца в химических реакциях являются: а) только восстановителями, б) только окислителями, в) проявляют окислительно-восстановительную двойственность? Ответ поясните.
36. Осуществите превращения, обозначив состояния веществ и назвав продукты:
а. MnO2 ®[Mn(H2O)6]2+ ® [Mn(OH)(H2O)5]+
б. KMnO4 ® MnSO4 ® Mn(OH)2 ®MnO2
в. KMnO4 ® MnO2 ®[Mn(H2O)6]2+ ® Mn(OH)2
37.Допишите уравнения реакций:
а. KMnO4 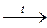
б. Mn(OH)2 + O2 + H2O ®
в. MnSO4 + NH4OH ®
г. Mn(OH)2 + HCl ®
д. KMnO4 + H2C2O4 + H2SO4 ® CO2 + …
е. MnO2 + KClO3 + KOH →
ж. KMnO4 + KI + H2O → KIO3 + …
з. MnSO4 + (NH4)2S2O8 + H2O → (NH4)2SO4 + ….
Окислительно-восстановительные реакции уравняйте электронно-ионным методом; для ионно-обменных – составьте краткие ионные уравнения.
38. Сколько граммов сульфита натрия содержалось в 20,0 мл раствора, если на его окисление в кислой среде потребовалось 19,6 мл раствора KMnO4 с молярной концентрацией эквивалента – с(1/5 KMnO4) равной 0,1 моль/дм3?
|
|
|
39. В мерной колбе на 500,00 мл растворили 0,315 г KMnO4. Вычислите молярную концентрацию эквивалента и титр полученного раствора.
40. В серной кислоте растворили без доступа воздуха 0,21 г железной проволоки. На окисление полученного сульфата железа (II) израсходовали 33,6 мл раствора KMnO4 с молярной концентрацией эквивалента – с
(1/5 KMnO4) равной 0,11 моль/дм3. Определите массовую долю железа (в %) в проволоке.
41. Какая масса KMnO4 потребуется при взаимодействии с концентрированной соляной кислотой для получения 10 литров хлора, измеренных при 18 оС и давлении 100 кПа?
42. Общая характеристика d -элементов: переменные степени окисления, образования устойчивых КС, окраска соединений.
43. Общая характеристика элементов VIB группы. Хром: строение атома, степени окисления, типы гибридизации.
44. Химическая активность металлического хрома.
45. Восстановительные свойства соединений хрома (II). Гидроксид хрома (II).
46. Соединения хрома (III). Амфотерность его гидроксида.
47. Соли хрома (III): растворимость, гидролиз. Окислительно-восстановительные свойства соединений хрома (III); получение.
48. Строение, свойства и получение комплексных соединений хрома (III).
49. Соединения хрома (VI): хромовый ангидрид, кислоты.
50. Хроматы и дихроматы, равновесие между ионами CrO42- и Cr2O72-.
51. Окислительные свойства соединений хрома (VI), зависимость от рН среды.
52. Пероксосоединения хрома.
53. Общая характеристика элементов VIIB группы. Химическая активность марганца (простого вещества).
54. Оксид и гидроксид марганца (II). Соли марганца (II), их растворимость, гидролиз.
55. Комплексные соединения марганца (II) и марганца (III).
56. Соединения марганца (IV). Диоксид марганца: кислотно-основные и окислительно-восстановительные свойства.
57. Соединения марганца (VI). Магнаты, их образование, устойчивость, диспропорционирование, условия стабилизации.
58. Соединения марганца (VII): оксид, марганцевая кислота. Перманганаты, окислительные свойства при различных рН раствора.
59. Термическое разложение. Использование растворов перманганата в фарманализе и как антисептического средства.
60. Общая характеристика d- элементов VIB группы. Хром – строение атома, степени окисления, типы гибридизации.
61. Химическая активность металлического хрома.
62. Соединения двухвалентного хрома: оксид, гидроксид, соли. Получение. Свойства.
63. Соединения трёхвалентного хрома: оксид, гидроксид, соли. Получение. Свойства.
64. Растворимость, способность к гидролизу солей трёхвалентного хрома.
65. Комплексные соединения трёхвалентного хрома, получение.
66. Окислительно-восстановительные свойства трёхвалентного хрома.
67. Соединения шестивалентного хрома: оксид, гидроксиды, соли. Получение. Свойства.
68. Равновесие в водных растворах между хромат- и дихромат-ионами, его механизм.
69. Окислительные свойства соединений шестивалентного хрома. Применение.
70. Пероксид хрома. Надхромовые кислоты. Получение. Свойства.
71. Общая характеристика VIIB группы. Химическая активность марганца.
72. Получение и свойства оксида и гидроксида двухвалентного марганца.
73. Соли двухвалентного марганца. Растворимость, гидролиз.
74. Комплексные соединения двухвалентного марганца.
75. Соединения четырёхвалентного марганца. Оксид. Получение и свойства.
76. Соединения шестивалентного марганца. Соли, их образование, устойчивость, способность к диспропорционированию, условия стабилизации.
77. Соединения семивалентного марганца. Оксид, гидроксид, соли. Окислительная способность при различных рН растворов.
78. Термическая устойчивость соединений марганца.
79. Биологическая роль марганца. Применение его соединений в медицине и фармации.
80. Осуществите превращения:
а. Cr(OH)3 →[Cr(OH)6]3– → CrO42– → Cr2O72– → Cr3+ → Cr2+
б. [Cr(H2O)6]3+ → [Cr(OH)(H2O)5]2+;
в. KMnO4→MnSO4 →Mn(OH)2 →MnO2;
г. MnO2→[Mn(H2O)6]2+→[Mn(OH)(H2O)5]+;
д. KMnO4→ MnO2→[Mn(H2O)6]2+→ Mn(OH)2 ;
81. Закончите уравнения реакций:
a. K2Cr2O7 + H2SO4 + FeSO4 →;
б. CrCl3+H2O2 + NaOH →;
в. Cr2(SO4)3 + PbO2+KOH→
г. KMnO4 + H2C2O4 + H2SO4 → CO2 +…;
д. MnO2 + KClO3+KOH→
е. KMnO4 + KI + H2O → KIO3 +…;
ж. MnSO4 + (NH4)2S2O8 + H2O →(NH4)2SO4 +…
82. Определите массовую долю дихромата натрия в продукте, если 1,0 г его в кислой среде окисляет 3,8 г иодида калия.
83. Какой объём раствора дихромата калия с концентрацией 0,1 моль/дм3 потребуется для окисления 10 г иодида калия в кислой среде?
84. Сплавлением 6,08 г оксида хрома (III) с окислителем с присутствии щёлочи получили 12,74 г хромата натрия. Определите выход продукта в %.
85. Определите массу перманганата калия для приготовления 200,00 см3 раствора с молярной концентрацией эквивалента 0,1 моль/дм3 в кислой среде.
86. Масса железа, растворённого в разбавленной серной кислоте без доступа воздуха, 0,21 г. Полученный сульфат двухвалентного железа прореагировал с 33,6 мл перманганата калия с молярной концентрацией эквивалента 0,1105 моль/дм3. Определите массовую долю железа в образце.
87. В мерной колбе вместимостью 500,00 мл растворили 0,315 г перманганата калия. Вычислите молярную концентрацию эквивалента для кислой среды и титр полученного раствора.
88. Какая масса перманганата калия потребуется для взаимодействия с HCl, если необходимо получить 10 л хлора при 18 оС и давлении 100 кПа?
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1928; Нарушение авторских прав?; Мы поможем в написании вашей работы!