
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
РЫБИНСК 2007 5 страница
Задача на термодинамику идеальных газов. В процессе решения необходимо использовать уравнение Клапейрона-Менделеева, уравнения сохранения массы и энергии, первое и второе начало термодинамики, уравнение Гюи-Стодолы для расчета потерь эксергии на основании чего построить эксергетическую диаграмму процесса смешения при заполнении резервуара с кислородом, втекающим в него углекислым газом.
Решение.
Рассчитаем объем углекислого газа, поступившего в резервуар за заданный промежуток времени прокачки
 м3.
м3.
Воспользуемся законом сохранения и найдем массу газовой смеси в резервуаре
 .
.
Массы компонентов можно найти из уравнения Клапейрона-Менделеева в
предположении идеальности смешивающихся газов:
 .
.
Тогда масса углекислого газа, поступившая в резервуар, будет равна:
 кг.
кг.
Масса кислорода, содержащегося в баллоне до смешения:
 кг.
кг.
Таким образом, масса газовой смеси будет равна:
 кг.
кг.
Найдем массовые доли компонентов, входящих в смесь:
для кислорода
 ,
,
для углекислого газа
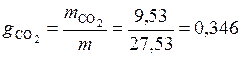 .
.
Проверим баланс по сумме массовых долей
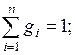
 .
.
Баланс сошелся.
Объемные доли компонентов можно найти по известным массовым долям, воспользовавшись соотношением:
 .
.
Кажущуюся молекулярную массу смеси определим, воспользовавшись очевидной зависимостью:
 .
.
Найдем газовые постоянные кислорода и углекислого газа:
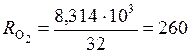 Дж/(кг×К);
Дж/(кг×К);
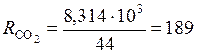 Дж/(кг×К).
Дж/(кг×К).
После подстановки получим:
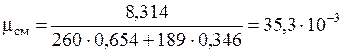 кг/моль.
кг/моль.
Тогда объемная доля кислорода равна:
 ;
;
объемная доля углекислого газа;
 .
.
Проверка  .
.
Газовая постоянная смеси равна
 Дж/(кг·К).
Дж/(кг·К).
Найдем по таблицам Приложения 2 удельные теплоемкости для кислорода и углекислого газа:
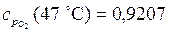 кДж/(кг×К);
кДж/(кг×К); 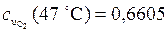 кДж/(кг×К);
кДж/(кг×К);  кДж/(кг×К);
кДж/(кг×К);  кДж/(кг×К).
кДж/(кг×К).
Запишем закон сохранения энергии для смешивающихся компонентов и газовой смеси:

или
 .
.
Откуда температура полученной в резервуаре смеси будет равна:
 .
.
Теплоемкость газовой смеси  найдем по известной зависимости, полученной для расчета газовых смесей:
найдем по известной зависимости, полученной для расчета газовых смесей:

 кДж/(кг×К).
кДж/(кг×К).
После подстановки в предшествующую формулу, найдем результирующую температуру газовой смеси:
 К.
К.
Это значение необходимо уточнить, пересчитав теплоемкости компонентов и теплоемкость смеси, при температуре смеси и методом последовательных приближений, добиться требуемого совпадения выбора теплоемкостей как функции от температуры с рассчитанным значением температуры смеси.
Конечное давление смеси  можно найти из уравнения Клапейрона-Менделеева:
можно найти из уравнения Клапейрона-Менделеева:
 Па = 0,5 МПа.
Па = 0,5 МПа.
Вычислим энтропии компонентов в состоянии до смешения и энтропию газовой смеси после окончания процесса, заполнения объема.
Для расчета энтропии воспользуемся зависимостями, приведенными в первой главе пособия при расчете газовых смесей.
Энтропия газов до смешения:
кислорода:

 Дж/К
Дж/К
углекислого газа:

 Дж/К.
Дж/К.
Энтропия системы до смешения равна сумме энтропий кислорода и углекислого газа:
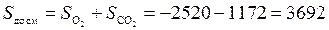 Дж/К.
Дж/К.
Удельная энтропия системы до смешения:
 Дж/(кг·К).
Дж/(кг·К).
Найдем энтропию образовавшейся газовой смеси как сумму энтропии компонентов, входящих в нее
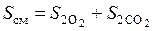 .
.
Энтропия кислорода:
 .
.
Энтропия углекислого газа:
 .
.
Найдем парциальное давление кислорода и углекислого газа в смеси:
 кПа;
кПа;
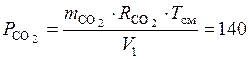 кПа.
кПа.
Следовательно,
 Дж/К;
Дж/К;
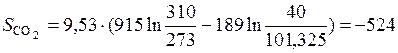 Дж/К.
Дж/К.
Тогда энтропия образовавшейся газовой смеси будет равна
 Дж/К.
Дж/К.
Найдем приращение энтропии за счет необратимости процесса смешения
 ;
;  Дж = 2,8 кДж.
Дж = 2,8 кДж.
Потери эксергии De за счет необратимости процесса смешения найдем воспользовавшись уравнением Гюи-Стодолы
 кДж.
кДж.
Эксергию покоящегося газа можно найти, воспользовавшись известным соотношением [4]:
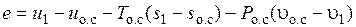 ,
,
где  – параметры системы (газа) соответствующие состоянию окружающей среды;
– параметры системы (газа) соответствующие состоянию окружающей среды;  – начальные параметры системы.
– начальные параметры системы.
Для потока газа эксергию 1 кг движущейся среды можно рассчитать, воспользовавшись зависимостью для потока [4]
 .
.
Дальнейшее решение можно строить, предполагая газ идеальным, а энтропию при 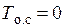 К равной нулю. В рассматриваемом примере используем таблицы термодинамических параметров газа по Ривкину [9], приведенных в Приложении настоящего пособия.
К равной нулю. В рассматриваемом примере используем таблицы термодинамических параметров газа по Ривкину [9], приведенных в Приложении настоящего пособия.
Найдем значения удельной эксергии и эксергии m кг исходных систем до смешения.
Для состояния, соответствующему нормальным физическим условиям из таблиц Приложения выпишем значения внутренней энергии  .
.
 кДж/кг,
кДж/кг,
а также их значения для начальной температуры  К:
К:
 кДж/кг.
кДж/кг.
Такие же данные выпишем и для диоксида углерода (СО2), 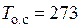 К;
К;  кДж/кг;
кДж/кг;  кДж/кг; для начального состояния
кДж/кг; для начального состояния  К;
К; 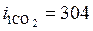 кДж/кг;
кДж/кг;  кДж/кг.
кДж/кг.
Тогда величина эксергии кислорода ( кг) до смешения составит величину
кг) до смешения составит величину
 .
.
Удельный объем кислорода при нормальных физических условиях

 кДж.
кДж.
Рассчитаем эксергию диоксида углерода
 .
.
Подставим численные значения
 кДж.
кДж.
Суммарная эксергия компонентов до смешения равна
 кДж.
кДж.
Найдем эксергию газовой смеси, образовавшейся в процессе смешения. Параметры газовой смеси:  °С,
°С,  МПа.
МПа.
Удельные объемы компонентов после смешения:
– кислорода 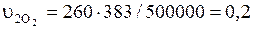 м3/кг;
м3/кг;
– диоксида углерода  м3/кг.
м3/кг.
Из таблиц Приложения 2 выпишем значения внутренних энергий при  °С;
°С;  кДж/кг;
кДж/кг;  кДж/кг.
кДж/кг.
Эксергия 18 кг кислорода в смеси равна
 .
.
После подстановки численных значений получим

 кДж.
кДж.
Эксергия диоксида углерода в смеси
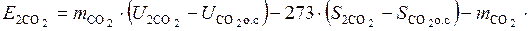
 .
.
После подстановки численных значений получим
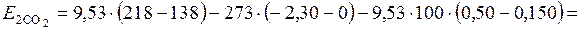
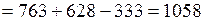 кДж.
кДж.
Эксергия смеси, равна сумме эксергий компонентов
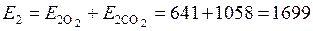 кДж.
кДж.
Потери эксергии в процессе смешения составят
 кДж.
кДж.
|
|
Дата добавления: 2015-05-09; Просмотров: 275; Нарушение авторских прав?; Мы поможем в написании вашей работы!