
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод Темкина-Шварцмана 2 страница
|
|
|
|
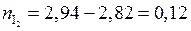 моль йода;
моль йода;
 моль водорода;
моль водорода;
 моль йодистого водорода.
моль йодистого водорода.
Подставим эти значения в выражение (5.44) и определим константу равновесия:
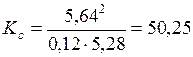 .
.
При добавлении к исходной смеси  йода и
йода и 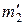 водорода вновь должно установится равновесие, но величина
водорода вновь должно установится равновесие, но величина 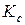 при этом не изменится. Найдем новые равновесные значения чисел молей всех веществ. Обозначим новые значения
при этом не изменится. Найдем новые равновесные значения чисел молей всех веществ. Обозначим новые значения  , тогда новые равновесные числа молей йода и водорода будут равны:
, тогда новые равновесные числа молей йода и водорода будут равны:
 ;
;
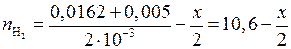 .
.
Подставим это в (5.44) и решим уравнение:
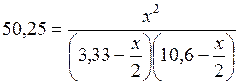 ;
;
 ;
;
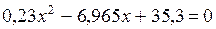 ;
;
 ,
,
откуда  моль;
моль;  моль.
моль.
Первый корень не имеет физического смысла, т. к. 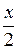 может быть только меньше 10,6 моль, в противном случае
может быть только меньше 10,6 моль, в противном случае  будет отрицательна. Таким образом, количество йодистого водорода составит 6,45 моль или 6,45·128·10-3 = 0,826 кг.
будет отрицательна. Таким образом, количество йодистого водорода составит 6,45 моль или 6,45·128·10-3 = 0,826 кг.
Из разобранного примера видно, что увеличение концентрации исходных веществ смещает равновесие в сторону повышения концентрации конечных веществ.
Ответ: 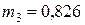 кг.
кг.
Пример 2. При 823 К и давлении 1,0133·105 Па степень диссоциации фосгена на окись углерода и хлор равна 77 %. Определить значения 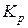 и
и 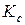 .
.
Дано:
T = 823 К
P = 1,0133·105 Па
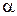 = 0,77 = 0,77
|
Найти:
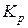 –? –? 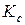 –? –?
|
Решение. Запишем реакцию диссоциации фосгена:
 .
.
Константа равновесия, выраженная через
парциальные давления, будет иметь вид:
 . (5.45)
. (5.45)
Парциальное давление представим как произведение общего давления на мольную долю данного компонента:
 ;
;  ;
;  , (5.46)
, (5.46)
где 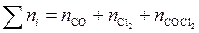 – суммарное число молей всех компонентов в равновесной смеси.
– суммарное число молей всех компонентов в равновесной смеси.
Подставим (5.46) в (5.45):
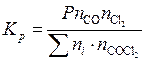 . (5.47)
. (5.47)
Числа молей компонентов в равновесной смеси найдем по формуле:
 (5.48)
(5.48)
где 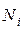 – число молей
– число молей 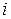 -го компонента в исходной смеси;
-го компонента в исходной смеси;  – стехиометрический коэффициент
– стехиометрический коэффициент 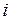 -го компонента в уравнении реакции.
-го компонента в уравнении реакции.
Знак «+» относится к продуктам реакции, знак «–» к исходным веществам.
Учитывая, что перед началом реакции  и
и  отсутствовали, т. е.
отсутствовали, т. е. 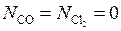 , а число молей
, а число молей  равно стехиометрическому количеству (
равно стехиометрическому количеству (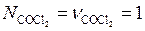 моль), получим из (5.48):
моль), получим из (5.48):
|
|
|
 ;
; 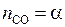 ;
; 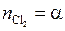 ;
;
 . (5.49)
. (5.49)
Подставим (5.49) в (5.47):
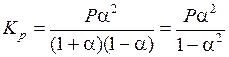 .
.
Подставим численные значения:
 (Па).
(Па).
Константу равновесия, выраженную через концентрации, найдем из уравнения:
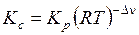 ,
,
где 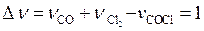 – изменение стехиометрических коэффициентов.
– изменение стехиометрических коэффициентов.
Следовательно,  моль/м3.
моль/м3.
Ответ: 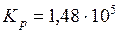 Па;
Па; 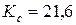 моль/м3.
моль/м3.
Пример 3. В реакции  при начальном давлении водяного пара 1,3325·105 Па после достижения равновесия при 473 К парциальное давление образовавшегося водорода равнялось 1,2717·105 Па. Определить выход водорода, если в сосуд объемом 2·10-3 м3, содержащий металлическое железо, ввести водяной пар под давлением 3,0399·105 Па при 473 К.
при начальном давлении водяного пара 1,3325·105 Па после достижения равновесия при 473 К парциальное давление образовавшегося водорода равнялось 1,2717·105 Па. Определить выход водорода, если в сосуд объемом 2·10-3 м3, содержащий металлическое железо, ввести водяной пар под давлением 3,0399·105 Па при 473 К.
Дано:
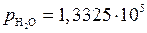 Па
T = 473 К Па
T = 473 К
 Па Па
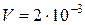 м3 м3
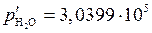 Па Па
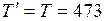 К К
|
Найти:
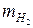 –? –?
|
Решение. Так как концентрации металлического железа и окиси железа в газовой фазе практически остаются постоянными, то константа равновесия может быть записана в виде:
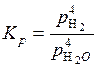 или
или 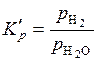 . (5.50)
. (5.50)
Реакция по условию идет без изменения объема, поэтому из закона Дальтона при достижении равновесия парциальное давление водяного пара будет равно:
 Па;
Па;
 Па.
Па.
Подставим эти значения в (5.50) и найдем
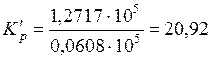 .
.
Количество молей получившегося водорода во втором случае:
 , (5.51)
, (5.51)
где  – парциальное давление водорода при равновесии, которое равно:
– парциальное давление водорода при равновесии, которое равно:
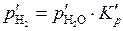 , (5.52)
, (5.52)
где  – парциальное давление водяного пара при равновесии, равное:
– парциальное давление водяного пара при равновесии, равное:
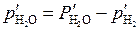 . (5.53)
. (5.53)
Подставим (5.53) в (5.52) и выразим 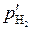 :
:
 .
.
Сделаем численный расчет:
 Па.
Па.
Массу образовавшегося водорода найдем, умножив число молей  на молярную массу
на молярную массу  кг/моль:
кг/моль:
 ;
;
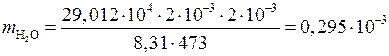 кг.
кг.
Ответ:  г.
г.
Пример 4.Определить стандартное сродство водорода к кислороду при T = 1000 К, если известно, что степень диссоциации водяного пара при этой температуре под давлением 1,0133·105 Па равна 7·10-7.
Дано:
T = 1000 К
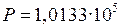 Па Па
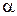 =7·10-7 =7·10-7
|
Найти:
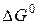 –? –?
|
Решение. На основании уравнения (5.33) вычислим стандартное сродство, равное изменению энергии Гиббса по формуле:
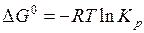 ,
,
где 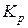 – константа равновесия данной реакции, выраженная в атмосферах, величину которой определим по известной степени диссоциации водяного пара:
– константа равновесия данной реакции, выраженная в атмосферах, величину которой определим по известной степени диссоциации водяного пара:
|
|
|
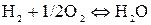 .
.
Если исходить из 1 моля H2O, то в равновесной смеси будет следующие количества H2O, H2 и O2:
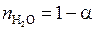 ;
; 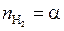 ;
;  .
.
Общее число молей в равновесной смеси:
 (моль).
(моль).
Тогда парциальные давления компонентов:
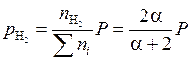 ;
;  ;
; 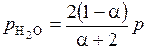 .
.
Отсюда 
Найдем значение 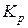 , учитывая, что р = 1 атм.:
, учитывая, что р = 1 атм.:
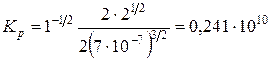 (атм.-1/2).
(атм.-1/2).
Тогда стандартное сродство будет равно:
 Дж/моль.
Дж/моль.
Ответ:  Дж/моль.
Дж/моль.
Дано:
T 1 = 600 К
 Па
Т 2 = 298 К Па
Т 2 = 298 К
|
Найти:
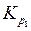 –? –?
|
Пример 5. Для реакции  определить
определить 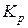 при 600 К, если при 298 К константа равновесия этой реакции равна 1,0·105.
при 600 К, если при 298 К константа равновесия этой реакции равна 1,0·105.
Решение. Так как температурный интервал велик, пренебрегать зависимостью теплового эффекта реакции от температуры нельзя. Эту зависимость можно получить из закона Кирхгофа:
 .
.
Зависимости теплоемкостей веществ, участвующих в реакции, от температуры  находим по П2.9:
находим по П2.9:
Таблица 5.8
| Вещество | Зависимость теплоемкости от температуры  , Дж/моль·К , Дж/моль·К
| ||
| a | b | 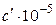
| |
| CO2 | 44,14 | 9,04 | –8,54 |
| H2 | 27,28 | 3,26 | 0,50 |
| CO | 28,41 | 4,10 | –0,46 |
| H2O(г) | 30,00 | 10,71 | 0,33 |
Находим 
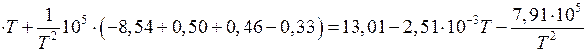 .
.
Следовательно, 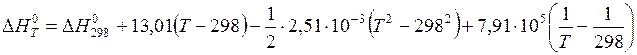 .
.
 находим по табл. 9 [14].
находим по табл. 9 [14].
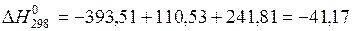 кДж/моль.
кДж/моль.


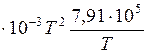 ;
;
Согласно уравнению изобары  , получим
, получим
 ;
;
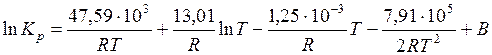 ;
;
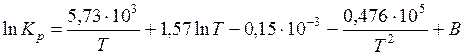 .
.
Постоянную интегрирования В можно найти по известному значению константы равновесия при Т 2 = 298 К:
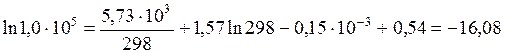 .
.
Подставим это значение константы интегрирования в ранее полученное нами уравнение зависимости  от температуры:
от температуры:
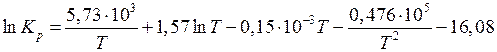 .
.
Найдем 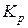 при
при  К:
К:
 .
.
Отсюда 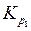 =26,87.
=26,87.
Ответ: 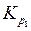 =26,87.
=26,87.
ЛИТЕРАТУРА
Основная
1. Исаев, С.И. Термодинамика [Текст]: Учебник для вузов/ С.И. Исаев. Изд-во 3-е, перераб. и доп. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2000.– 416 с.
2. Кудинов, В.А. Техническая термодинамика [Текст]: Учебное пособие / В.А. Кудинов; Э.М. Карташов. – Изд-во 2-е исправл. – М.: Высш. шк., 2001.– 261 с.
3. Ерофеев, В.Л. Теплотехника [Текст]: Учебник / В.Л. Ерофеев; П.А. Пряхин. – М.: ИКЦ «Академкнига», 2006.– 488 с.
4. Александров, А.А. Термодинамические основы циклов теплоэнергетических установок [Текст]: Учебное пособие / А.А. Александров. – М.: Изд-во МЭИ, 2004.– 158 с.
5. Прибытков, И.А. Теоретические основы теплотехники [Текст]: Учебник / И.А. Прибытков; Под ред. И.А. Прибытков; И.А. Левицкий. – М.: Изд.центр «Академия» 2004.– 464 с.
6. Теплотехника [Текст]:Учебник / Под ред. В.Н. Луканина. – М.: Высш. шк., 2000.– 671 с.
Дополнительная
7. Юдаев, Б.Н. Техническая термодинамика. Теплопередача / Б.Н. Юдаев. – М.: Высшая школа, 1988.– 475 с.
|
|
|
8. Рабинович, О.М. Сборник задач по технической термодинамике. – М.: Машиностроение, 1969.– 240 с.
9. Ривкин, С.Л. Термодинамические свойства газов. – М.: Энергоатомиздат, 1987.– 287 с.
10. Кузовлев, В.А. Техническая термодинамикаи основы теплопередачи [Текст]: Учебное пособие / В.А. Кузовлев. Под ред. Л.Р. Стоцкого. 2-е изд., перераб. и доп. – М.: Высш. Шк. 1983.– 335 с.
11. Нащокин, В.В. Техническая термодинамика и теплоотдача. – М.: Высшая школа, 1980.– 496 с.
12. Энергетические расчеты технических систем [Текст]:Справочное пособие / В.М. Бродянский. – Киев.: Наукова думка, 1991.– 360 с.
13. Техническая термодинамика [Текст] / Учебник для вузов под ред. В.И. Крутова. – М.: Высшая школа, 1981.– 439 с.
14. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Понамаревой. – Л.: Химия, 1983.– 232 с.
15. Сборник задач по технической термодинамике [Текст]: Учебное пособие / Т.Н. Андрианов, Б.В. Дзамнев, В.Н. Зубарев, С.А. Ремецев. – М.: Энергоиздат, 1981.– 240 с.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1191; Нарушение авторских прав?; Мы поможем в написании вашей работы!