
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория (модель) активированного комплекса
Константы скоростей химических реакций
Успешная работа таких программ по предсказанию химических процессов требует знания констант скоростей. Теоретические методы их определения пока работают лишь для простейших систем. Для обработки и систематизации экспериментальных данных (основного источника k) до сих пор используется эмпирическое уравнение Аррениуса
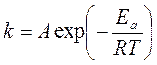 (3.62)
(3.62)
где Ea – энергия активации, A – предэкспоненциальный множитель.
В нижеследующей табличке представлены примеры экспериментально найденных кинетических констант.
| Уравнение реакции | Среда | Порядок реакции | A | Eа, кДж/моль |
| C2H5Br = C2H4 + HBr | газ | 7,2×10–12 c–1 | 218,0 | |
| H2 + C2H4 = C2H6 | газ | 4×107 м3/(моль×c) | 180,5 | |
| CH3Br + J– = CH3J + Br– | р-р H2O | 1,7×107 м3/(моль×c) | 76,6 |
Углубленное представление об элементарном акте химических реакций дает теория или модель активированного комплекса (МАК). При этом предполагается, что при сближении реагирующих молекул наблюдается почти непрерывный переход из начального в конечное состояние, который протекает через переходное состояние или активированный комплекс ( АК ) с максимумом потенциальной энергии Епот. Разность Епот активированного комплекса и исходных веществ, своеобразный энергетический барьер, названа энергией активации Еа реакции.
Еа определяется по Епот как функции взаимных расстояний всех участвующих в реакции атомов. Для линейного расположения атомов А, В и С простой реакции: А + ВС → (А∙В∙С)¹→АВ + С результатквантово-химическогорасчёта Епот от межъядерных расстояний
| х B – C и х A - B можно наглядно отобразить в виде диаграммы потенциальных кривых. Наиболее вероятный путь реакции (при наименьшей затрате энергии) ведет через состояние активированного комплекса. Изменение Епот вдоль координаты реакции схематично показано на рис.3.3 
| |||
| Рис.3.3. Потенциальная энергия вдоль координаты реакции |
Обозначим стехиометрические коэффициенты реагентов n' i º ai, а переходное состояние активированного комплекса A ¹, тогда химическое уравнение однобарьерной реакции
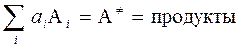 . (3.63)
. (3.63)
Определяющий постулат МАК (Эйринг, Поляни):
"Скорость реакции равна концентрации c ¹ активированного комплекса на вершине барьера, помноженной на частоту ν ¹ пересечения этого барьера."
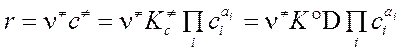 . (3.64)
. (3.64)
В (3.64) использованы: записанный для реагентов и АК «концентрационный» ТЗДМ 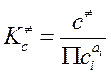 , взаимосвязь констант
, взаимосвязь констант 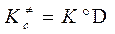 (см. ( 3.50 с )) и введено обозначение D = (RT/Р°)-Δν = (RT/P°) n -1,
(см. ( 3.50 с )) и введено обозначение D = (RT/Р°)-Δν = (RT/P°) n -1,
а Δν = 1 - n выражено через порядок реакции n.
Из сопоставления (3.64) с КЗДМ (3.58) константа скорости равна
k = ν ≠K° D. (3.65)
Активированный комплекс ( АК ) как неустойчивое переходное образование, в котором прежние химические связи еще не разорваны, а новые еще не до конца образовались, характеризуется избытком колебательных степеней свободы. При этом из константы равновесия K° можно выделить колебательную составляющую, определяющую переход через АК: K° = K≠ exp(–Δ G (ν ≠)/ RT ) ≈ K≠∙k Б T /(h ν ≠).
Подстановка полученного выражения в(3.65) дает окончательную формулу для константы скорости в МАК:
k = (k Б T/h) D K≠ = (k Б T/h) Dexp(- Δ rG≠/RT). (3.65')
k = (k Б T/h) D exp(- Δ rH≠/RT +Δ rS≠/R)(3.65'')
Сопоставление (3.65'') с формулой Аррениуса раскрывает смысл эмпирически введенных энергии активации, как энтальпии реакции перехода реагентов в АК, а также предэкспоненциального сомножителя, образованного универсальным частотным фактором и энтропией реакции перехода реагентов в АК.
Ea= Δ rH≠, A= (k Б T/h) D exp(Δ rS≠/R). (3.66)
Размерность константы скорости определяется размерностями входящих в А частотного фактора [ k Б T/h ] = 1/с и [D] = [ К ≠с].
Главное в том, что теоретическое выражение МАК определяет квантово-статистический способ расчета констант скоростей химических реакций. А самое замечательное при выводе − это сокращение постулируемой частоты пересечения барьера и выделенной из АК частоты слабейшего колебательного звена, определяющего реакционное преобразование компонентов.
|
|
Дата добавления: 2015-05-09; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!

