
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Действие нитратов и нитритов на организм
|
|
|
|
III. Токсичность биогенных элементов.
В организме элементы могут претерпевать химические изменения и превращаться в вещества, оказывающие токсическое действие на организм. Существует понятие критической концентрации элемента в клетке, при достижении которой функции клетки нарушаются, а превышение критической концентрации приводит к гибели клетки.
Примеры: токсичное действие нитратов и кислорода.
Это особенно значительно проявляется при развитии некоторых профессиональных заболеваний:
· алюминоз – добыча и переработка алюминия
· силикоз – керамическая промышленность
· антракоз – угледобывающая отрасль
и т.д.
Нитраты, соли азотной кислоты, NO 3– не отличаются высокой токсичностью.
При поступлении в организм под действием микрофлоры кишечника они восстанавливаются в нитриты:
NO 3– + 2ē ® NO 2–
Нитриты очень токсичны:
· во первых, они вызывают тканевую гипоксию, т.к. окисляют Fe 2+ в гемоглобине. В результате образуется метгемоглобин, который не способен транспортировать кислород (О 2)
Hb + NO 3– + 2Н + ® метHb + NO + Н 2 О
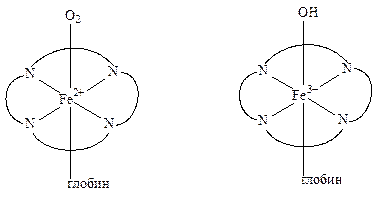
· 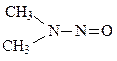 во-вторых, они образуют канцерогенные вещества – нитрозосоединения.
во-вторых, они образуют канцерогенные вещества – нитрозосоединения.
Например, диметилнитрозамин
Способен вызвать рак практически всех внутренних органов. Международные нормы: ПДК = 40 мг/кг или л
2. Токсичность кислорода (О2).
Превращение кислорода в организме можно представить следующей схемой:
O 2 + 4Н + + 4ē ® 2Н 2 О
Однако, данное превращение включает 4 стадии:
· O 2 + 1ē ® О 2. – (супероксид-анион-радикал)
· О 2. – + 1ē + 2Н + ® Н 2 О 2 (пероксид водорода)
· Н 2 О 2 + 1ē + Н + ® Н 2 О + ОН . (гидроксид-радикал)
· ОН . + 1ē + Н + ® Н 2 О
Таким образом, при полном восстановлении молекула кислорода, принимая четыре электрона и четыре иона водорода, образует две молекулы воды.
|
|
|
При неполном восстановлении кислорода образуются различные кислородсодержащие токсичные радикалы и молекулы: О 2. –, Н 2 О 2, ОН .. Токсичные активные формы кислорода могут образовываться и при взаимодействии его с металлопротеинами (гемоглобин, цитохромы), содержащими катионы металла в низших степенях окисления: Fe 2+, Mn 2+, Cu +.
Например: [Prot · Fe 2+ ] + O 2 ® [Prot · Fe 3+ ] + O 2.
2[Prot · Fe 2+ ] + O 2 + 2H + ® 2[Prot · Fe 3+ ] + H 2 O 2
Образовавшиеся частицы активно атакуют биосубстрат вплоть до разрыва связей С-С и С-Н, т.е. происходит глубокая деструкция молекул биосубстрата. Например: пероксидное окисление липидов (разрушение липидного слоя мембран), приводит к гибели клеток, а следовательно, и тканей, органов.
При экстремальных и патогенных воздействиях на организм образование кислородных радикалов в клетках и тканях усиливается. Факторами, усиливающими свободно-радикальное окисление, являются: радиоактивное, ультразвуковое и лазерное излучение; шум, вибрация; простудные и легочные заболевания; атеросклероз, инфаркт миокарда, остеохондроз, диабет, язва желудка, туберкулез и онкологические заболевания.
Возможно, свободно-радикальное окисление является не только следствием этих болезней, но и одной из причин их возникновения.
К счастью, существуют механизмы самозащиты клеток. В организме свободно-радикальное окисление сдерживается многокомпонентной антиоксидантной системой, которая превращает радикалы в малоактивные соединения.
Эти функции осуществляют:
· антиоксидантные ферменты: супероксиддисмутаза, каталаза, глутатионпероксидаза.
· антиоксиданты (органические соединения с выраженными восстановительными свойствами)
Частичная детоксикация этих окислителей происходит при участии природных антиоксидантов, например, аскорбиновой кислоты, витамина Е и глутатиона. Кроме того, пероксид водорода обезвреживается под действием ферментов каталаз и пероксидаз:
|
|
|
2Н 2 О 2 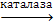 О 2 + 2Н 2 О
О 2 + 2Н 2 О
Н 2 О 2 + ДН 2  Д + 2Н 2 О
Д + 2Н 2 О
где ДН 2 – восстановленные органические соединения, выступающие в роли донора водорода.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 450; Нарушение авторских прав?; Мы поможем в написании вашей работы!