
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплота, работа и внутренняя энергия в простейших процессах
|
|
|
|
Уравнение адиабаты идеального газа
Адиабатный процесс – процесс без теплообмена с окружающей средой: dQs=0, энтропия S=const. Любой газ до 3 МПа можно условно считать идеальным, а до 50 МПа – с погрешностью. Идеальный газ - научная абстракция при которой полагается, что молекулы не имеют объема (считаются материальными точками) и отсутствуют силы межмолекулярного взаимодействия (силы взаимного притяжения, отталкивания).
Уравнения адиабаты идеального газа (три уравнения Пуассона):
1).Pvk=const, P1v1k=P2v2k…=const;
2).Тvk-1=const, Т1v1k-1=Т2v2k-1…=const;
3).ТР-((k-1)/k)=const, Т1Р1-((k-1)/k)=Т2Р2-((k-1)/k)…=const,
где Р абсолютное давление в (Па); Т – абсолютная термодинамическая температура, (К); v – удельный объем(м3/кг); k - показатель адиабаты: К=Ср/СV=Сμр/СμV; Ср>СV в К раз

Простейшие процессы или изопроцессы – это процессы, где какой то один из параметров (Р, Т, S, v) поддерживается постоянным.
1) В изохорном процессе v=const, Аv=0, из общей формулы работа:  (Работа - площадь под кривой), где Р абсолютное давление в (Па).
(Работа - площадь под кривой), где Р абсолютное давление в (Па).
По 1-у закону термодинамики: Qv=∆Uv; Изменение внутренней энергии: 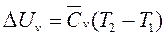 , где
, где 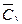 - средняя удельная изохорная теплоемкость в диапазоне от начальной температуры Т1 до конечной температуры Т2;
- средняя удельная изохорная теплоемкость в диапазоне от начальной температуры Т1 до конечной температуры Т2;

2) Изобарный процесс. Работа Ар=Р(v2-v1), где v1 и v2 – удельный начальный и конечный объемы; Теплота  , где
, где  - средняя удельная изобарная теплоемкость; J2-J1 – удельные энтальпии системы в начальном и конечном состоянии. (Используются в диаграммах: JS (для пара) и Jd (для влажного воздуха)). Изменение внутренней энергии:
- средняя удельная изобарная теплоемкость; J2-J1 – удельные энтальпии системы в начальном и конечном состоянии. (Используются в диаграммах: JS (для пара) и Jd (для влажного воздуха)). Изменение внутренней энергии: 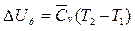 ;
;

3) Изотермический процесс Т=const, ∆U=0. QT=AT – теплота идет на совершение работы; Работа АТ=RTℓn(P1/P2)=RTℓn(v2/v1);
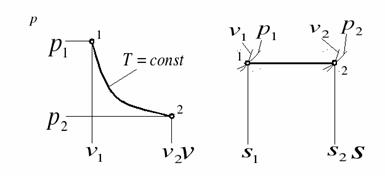
(P-V и T-S координаты)
4) Адиабатный процесс – процесс без теплообмена с окружающей средой: энтропия S=const, dQ=0, As=-∆Us – работа совершается за счет внутренней энергии системы. Изменение внутренней энергии:  ; Работа: As=(P1v1-P2v2)/(K-1) или As= RT/(K-1)[1-(Т2/Т1)].
; Работа: As=(P1v1-P2v2)/(K-1) или As= RT/(K-1)[1-(Т2/Т1)].
|
|
|

|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!