
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физический смысл энергии Гиббса
Свободная энергия Гиббса
энергию Гиббса химической реакции ∆G можно рассчитать как сумму энергий Гиббса образования продуктов реакций за вычетом энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. По-другому наз-ся изобарный, изотермический потенциал. Обозначается ∆G [к дж/моль]. Энергия Гиббса простых веществ=0. Энергия ∆G Гиббса при простой температуре ∆Т=0,
∆G=∆H 0298-Т∆S298(х.р)
Изменение свободной энергии равно максимально полезной работе, которую совершает система в изобарно-изотермическом процессе.
По энергии Гиббса мы можем определить самопроизвольность протекания реакции:∆G>0 (не самопроиз-ый)∆G=0(равновесный)∆G<0(самопроиз-ое теч реакции в прямом направлении)
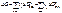
Самопроизвольность протекания реакций (2-ой закон термодинамики)
Самопроизвольным называют процесс, который протекает самопроизвольно без воздействия внешних факторов. Сущ. еще 1 функция сост.-я энтропия, которая показывает самопроизвольность протекания реакций
1850г. Клазиус - теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. Обратный процесс можно получить, только оказав внешнее воздействие.
1896г. Больцман - в изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энтропии т.е.:∆S>0 (самопроиз-ый) ∆S=0(равновесный) ∆S<0(не самопроиз-ый)
максимальная работа,которую может совершить система при равновесном проведении процесса в изохорно-изотермических условиях,равна изменению энергии Гельмгольца системы ∆F= ∆U-T∆S
27.1911 г.Планк «при абсолютном нуле энтропия идеального кристалла равна нулю.»третий закон термод. по мере повышения температуры растет скорость различных видов движений частиц, т.е число их микросостояний и соответственно термодинамическая вероятность и энтропия вещества.
28. Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени и единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. равновесные концентрации обозначаются символом вещества в квадратных скобках. Например, равновесные концентарции водорода и аммиака будут обозначаться [Н2] и [NH3].Равновесное парциальное давление будем обозначать индексом р.
Итак, термодинамическим условием химического равновесия является равенство энергии Гиббса химической реакции нулю, т.е. ∆G = 0 Константа химического равновесия. ∆G° = -RT ln([L] l [M]m / [D] d [В]b),[L], [M], [D], [В]равновесные концентрации соответствующих веществ; l, т, d и b показатели степени, равные стехиометрическим коэффициентам. Kравн = [L]l[M]m/[D]d[B]b Кр=Кравн(RT) Dn
Kр = exp(-DH/(RT)+ DS/R) Правило Ван-Гоффа. V2 = V1×gDT/ 10
29.при внешнем воздействии на систему происходит смещение хим.равновесия, т.е изменяются равновесные концентрации исходных веществ и продуктов реакции.если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо.а если увеличиваются равновесные концентрации исходных веществ, то смещение равновесия происходит влево.принцип Ле Шателье: Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие. Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.

30.чтобы произошла реакция, необходимо столкновение реагирующих частиц.при одной и той же температуре число столкновений растет с увеличением числа реагирующих частиц в еденице объема,т.е с возрастанием концентрации реагентов.скорость реакции повышается с увеличением концентрации реагирующих веществ.
|
Дата добавления: 2015-05-09; Просмотров: 3386; Нарушение авторских прав?; Мы поможем в написании вашей работы!