
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы к экзамену по предмету « Химия»
|
|
|
|
1.Предмет химия. Роль химии в промышленности и сельском хозяйстве.
2. Атомно- молекулярное учение в химии.
3. Основные законы в химии.
4. рЗакон Авогадро.
5. Понятие об относительной атомной и молекулярной массе.
ОТНОСИТЕЛНЫЕ АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ МАССЫ.МОЛЬ. ЧИСЛО АВОГАДРО.МОЛЯРНАЯ МАССА.МОЛЯРНЫЙ ОБЪЁМ.
В этом разделе познакомимся с величинами, которыми вы часто будете пользоваться при решении задач, выполнении упражнений.
Современные методы исследования позволяют определить чрезвычайно малые массы атомов с большой точностью. Так, например, масса атома углерода равна 1,993·10-26 кг. Это очень маленька величина.Поэтому в химии используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята атомная единица массы, равная 1/12 части массы атома углерода.
Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода. Она обозначается буквой Аr. Относительные атомные массы указаны в периодической таблице. Например Аr(Н)=1, Аr(Р)=31. Атомные массы округляем до целых величин, исключая атом хлора- Аr(Cl)=35,5.
Относительной молекулярной массой вещества называется величина, покаывающая во сколько раз масса молекулы больше 1/12 массы атома углерода. Она обозначается Мr. Вы знаете, что молекулы состоят из атомов, поэтому относительная молекулярная масса складывается из суммы атомных масс атомов, составляющих молекулу,с учётом числа атомов. Например Мr(H2SO4)=1·2+32+16·4=98.
Введём ещё одну величину - количество вещества, которое измеряется в молях.
Моль-это количество вещества, содержащее столько структурных единиц(атомов, молекул, ионов), сколько атомов содержится в 12 г углерода. Обозначается буквой ν (ню)
Зная массу атома углерода 1,993·10-26 кг можно вычислить число атомов в 0,012 кг углерода:
|
|
|
NA=0,012/1,993·10-26=6,02·1023
Это число называется постоянной Авогодро и обозначается NA, размерность 1/моль или моль -1,и показывает число структурных единиц в моле любого вещества. Т.е. 1 моль любого вещества содержит одинаковое число структурных единиц 6,02·1023. Используя эту величину можноопределить количество вещества по формуле:

С числом частиц работать трудно, поэтому вводится понятие молярная масса, которая показывает чему равна масса 1 моль конкретного вещества. Молярная масса равна отношению массы вещества к количеству вещества, обозначается буквой М.
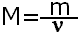
Молярная масса рассчитывается так же как и относительная молекулярная масса, но в отличии от неё имеет размерность г/моль. Например М(H2SO4)=1·2+32+16·4=98г/моль.Это означает, что масса 1 моль серной кислоты равна 98 г.
Ещё интересно то, что один моль любого газообразного вещества занимает объём 22,4 литра. Эта закономерность была установлена итальянским учёным Амадео Авргадро. Для газов можно использовать величину молярный объём, который обозначается буквой Vm, Vm=22.4 моль/л.
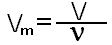
где V-объём газа в л.
6. Химические знаки, формулы, уравнения.
Знаки химические, химические символы, сокращённые буквенные обозначения химических элементов. Современные знаки химические (см. таблицу) состоят из первой буквы или первой и одной из следующих букв латинского названия элементов.
В формулах химических и уравнениях химических каждый знак химический выражает, кроме названия элемента, относительную массу, равную его атомной массе. Для обозначения изобаров и изотопов к их знакам химическим приписывают сверху слева (иногда справа) массовое число; атомный номер пишут снизу слева. Если же хотят обозначить не нейтральный атом, а ион, то вверху справа ставят заряд иона. Внизу справа указывают число атомов данного элемента вмолекуле. Примеры: 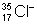 — однозарядный ион изотопа хлора (атомный номер 17, массовое число 35);
— однозарядный ион изотопа хлора (атомный номер 17, массовое число 35); 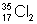 —двухатомная молекула того же изотопа. Изобары аргона и кальция обозначаются соответственно
—двухатомная молекула того же изотопа. Изобары аргона и кальция обозначаются соответственно  и
и  . Приведённые в таблице знаки химические являются международными, но наряду с ними в некоторых странах употребительны знаки, произведённые от национальных названий элементов.
. Приведённые в таблице знаки химические являются международными, но наряду с ними в некоторых странах употребительны знаки, произведённые от национальных названий элементов.
|
|
|
Например, во Франции вместо знаков химических азота N, бериллия Be и вольфрама W приняты Az (Azote), Gl (Glucinium) и Tu (Tungstène). В США вместо знака ниобия Nb нередко применяют Cb (Columbium). Необщеприняты названия и знаки элементов с атомными номерами 102 и 103 («нобелий» и «лоуренсий»).
Историческая справка. Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других (см. рис.). Семь металловдревности изображали астрономическими знаками семи небесных светил: Солнца (золото), Луны (серебро), Юпитера (олово), Венеры (медь), Сатурна (свинец), Меркурия (ртуть), Марса (железо). Металлы, открытые в 15—18 вв., — висмут,цинк, кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной иазотной кислот) составлены из знака воды Ñ и прописных букв F, соответственно R. Знак стекла (лат. vitrum) образован из двух букв V — прямой и перевёрнутой.
Попытки упорядочить старинные знаки химические продолжались до конца 18 в. В начале 19 в. английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Знаки химические Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками химическими, которые шведский химик И. Я. Берцелиус предложил в 1814. Высказанные им принципы составления знаков химических сохранили свою силу до настоящего времени; они изложены в начале статьи. В России первое печатное сообщение о знаках химических Берцелиуса сделал в 1824 московский врач И. Я. Зацепин.
|
|
|
Знаки, названия, атомные номера и атомные массы химических элементов
| Знак* | Латинское название | Русское название | Атом- ный номер | Атомная масса** | Знак* | Латинское название | Русское название | Атом- ный номер | Атомная масса** |
| Ac | Actinium | Актиний | [ 227] | Mg | Mgnesiom | Магний | 24,305 | ||
| Ag | Argentum | Серебро | 107,8680 | Mn | Manganum | Марганец | 54,9380 | ||
| Al | Aluminium | Алюминий | 26,98154 | Mo | Molebdaenum | Молибден | 95,94 | ||
| Am | Americium | Америций | [243] | N | Nitrogenium | Азот | 14,0067 | ||
| Ar | Argonum | Аргон | 39,948 | Na | Natrium | Натрий | 22,98977 | ||
| As | Arsenicum | Мышьяк | 74,9216 | Nb | Niobium | Ниобий | 92,9064 | ||
| At | Astatium | Астат | [210] | Nd | Neodymium | Неодим | 144,24 | ||
| Au | Aurum | Золото | 196,9665 | Ne | Neonum | Неон | 20,179 | ||
| B | Borum | Бор | 10,810 | Ni | Niccolum | Никель | 58,71 | ||
| Ba | Baryum | Барий | 137,34 | (No) | (Nobelium) | (Нобелий) | [255] | ||
| Be | Beryllium | Берилий | 9,01218 | Np | Neptunium | Нептуний | 237,0482 | ||
| Bi | Bismuthum | Висмут | 208,9804 | O | Oxygenium | Кислород | 15,9994 | ||
| Bk | Berkelium | Беркелий | [247] | Os | Osmium | Осмий | 190,2 | ||
| Br | Bromum | Бром | 79,904 | P | Phosphorus | Фосфор | 30,97376 | ||
| C | Carboneum | Углерод | 12,011 | Pa | Protactinium | Протактиний | 231,0359 | ||
| Ca | Calcium | Кальций | 40,08 | Pb | Plumbum | Свинец | 207,2 | ||
| Cd | Cadmium | Кадмий | 112,40 | Pd | Palladium | Палладий | 106,4 | ||
| Ce | Cerium | Церий | 140,12 | Pm | Promethium | Прометий | [145] | ||
| Cf | Californium | Калифорний | [251] | Po | Polonium | Полоний | [209] | ||
| Cl | Chlorum | Хлор | 35,453 | Pr | Praseodymium | Празеодим | 140,9077 | ||
| Cm | Curium | Кюрий | [247] | Pt | Platinum | Платина | 195,09 | ||
| Co | Cobaltum | Кобальт | 58,9332 | Pu | Plutonium | Плутоний | [244] | ||
| Cr | Chromium | Хром | 51,996 | Ra | Radium | Радий | 226,0254 | ||
| Cs | Caesium | Цезий | 132,9054 | Rb | Rubidium | Рубидий | 85,4678 | ||
| Cu | Cuprum | Медь | 63,546 | Re | Rhenium | Рений | 186,2 | ||
| Dy | Dysprosium | Диспрозий | 162,50 | Rh | Rhodium | Родий | 102,9055 | ||
| Er | Erbium | Эрбий | 167,26 | Rn | Radonum | Радон | [222] | ||
| Es | Einsteinium | Эйнштейний | [254] | Ru | Ruthenium | Рутений | 101,07 | ||
| Eu | Europium | Европий | 151,96 | S | Sulphur | Сера | 32,06 | ||
| F | Fluorum | Фтор | 18,99840 | Sb | Stibium | Сурьма | 121,75 | ||
| Fe | Ferrum | Железо | 55,847 | Sc | Scandium | Скандий | 44,9559 | ||
| Fm | Fermium | Фермий | [257] | Se | Selenium | Селен | 78,96 | ||
| Fr | Francium | Франций | [223] | Si | Silicium | Кремний | 28,086 | ||
| Ga | Gallium | Галлий | 69,72 | Sm | Samarium | Самарий | 150,4 | ||
| Gd | Gadolinium | Гадолиний | 157,25 | Sn | Stannum | Олово | 118,69 | ||
| Ge | Germanium | Германий | 72,59 | Sr | Strontium | Стронций | 87,62 | ||
| H | Hydrogenium | Водород | 1,0079 | Ta | Tantalum | Тантал | 180,949 | ||
| He | Helium | Гелий | 4,00260 | Tb | Terbium | Тербий | 158,9254 | ||
| Hf | Hafnium | Гафний | 178,49 | Tc | Technetium | Технеций | 98,9062 | ||
| Hg | Hydrargyrum | Ртуть | 200,59 | Te | Tellurium | Теллур | 127,60 | ||
| Ho | holmium | Гольмий | 164,9304 | Th | Thorium | Торий | 232,0381 | ||
| I | Iodum | Иод | 126,9045 | Ti | Titanium | Титан | 47,90 | ||
| In | Indium | Индий | 114,82 | Tl | Thallium | Таллий | 204,37 | ||
| Ir | Iridium | Иридий | 192,22 | Tm | Thulium | Тулий | 168,9342 | ||
| K | Kalium | Калий | 39,098 | U | Uranium | Уран | 238,029 | ||
| Kr | Kryptonum | Криптон | 83,80 | V | Vanadium | Ванадий | 50,94 | ||
| Ku | Kurtschatovim | Курчатовий | [261] | W | Wolframium | Вольфрам | 183,85 | ||
| La | Lanthanum | Лантан | 138,9055 | Xe | Xenonum | Ксенон | 131,30 | ||
| Li | Lithium | Литий | 6,941 | Y | Yttrium | Иттрий | 88,9059 | ||
| (Lr) | (Lawrencium) | (Лоуренский) | [256] | Yb | Ytterbium | Иттербий | 173,04 | ||
| Lu | Lutetium | Лютеций | 174,97 | Zn | Zincum | Цинк | 65,38 | ||
| Md | Mendelevium | Менделевий | [258] | Zr | Zirconium | Цирконий | 91,22 |
* В круглых скобках приведены необщепринятые знаки и названия элементов с атомными номерами 102 и 103. ** Атомные массы приведены по углеродной шкале (атомная масса изотопа углерода 12С равна 12 точно) и соответствуют международной таблице 1971. В квадратных скобках приведены массовые числа наиболее долгоживущих изотоповрадиоактивных элементов.
|
|
|
Лит.: Ломоносов М. В., Полн. собр. соч., т. 2, М. — Л., 1951, с. 706—709; Джуа М., История химии, пер. с итал., М., 1966; Crosland М. P., Historical studies in the language of chemistry, L., 1962.
С. А. Погодин.

|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!