
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия как функция состояния. Энтропия идеального газа
|
|
|
|
Величина S, определяемая соотношением 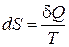 (только для обратимых процессов), называется энтропией системы. Это понятие было введено в термодинамику Клаузиусом в середине XIX века.
(только для обратимых процессов), называется энтропией системы. Это понятие было введено в термодинамику Клаузиусом в середине XIX века.
Несмотря на то, что изменение количества теплоты зависит от процесса, энтропия является функцией состояния. Для необратимых процессов будет выполняться неравенство: 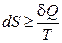 . Интегрируя обе части полученного выражения получим неравенство, которое называется неравенством Клаузиуса:
. Интегрируя обе части полученного выражения получим неравенство, которое называется неравенством Клаузиуса: 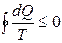 , которое для квазистатических (процессов, состоящих из непрерывно следующих друг за другом равновесных состояний) процессов переходит в равенство
, которое для квазистатических (процессов, состоящих из непрерывно следующих друг за другом равновесных состояний) процессов переходит в равенство 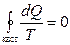 .
.
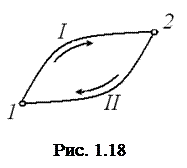 Пусть система может переходить из начального состояния 1 (рис. 1.18) в конечное состояние 2 несколькими способами, каждый из которых является квазистатическим процессом. Возьмём два из них I и II. Эти процессы можно объединить в один квазистатический круговой процесс 1" I "2" II "1. Применим равенство Клаузиуса:
Пусть система может переходить из начального состояния 1 (рис. 1.18) в конечное состояние 2 несколькими способами, каждый из которых является квазистатическим процессом. Возьмём два из них I и II. Эти процессы можно объединить в один квазистатический круговой процесс 1" I "2" II "1. Применим равенство Клаузиуса:
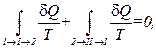 или
или
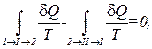 или, наконец,
или, наконец,
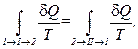 (1.78)
(1.78)
Количество теплоты, полученное системой, делённое на абсолютную температуру Т, при которой оно было получено, иногда называют приведённым количеством теплоты. Величина 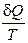 есть элементарное приведённое количество теплоты, полученное в бесконечно малом процессе, а интеграл
есть элементарное приведённое количество теплоты, полученное в бесконечно малом процессе, а интеграл 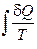 можно назвать приведённым количеством теплоты, полученным в конечном процессе. Тогда равенству Клаузиуса (1.78) можно дать следующую формулировку: приведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода, а определяется лишь начальным и конечным положениями системы. Этот результат позволяет ввести новую функции состояния – энтропию. То есть энтропия – функция состояния.
можно назвать приведённым количеством теплоты, полученным в конечном процессе. Тогда равенству Клаузиуса (1.78) можно дать следующую формулировку: приведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода, а определяется лишь начальным и конечным положениями системы. Этот результат позволяет ввести новую функции состояния – энтропию. То есть энтропия – функция состояния.
|
|
|
Рассчитаем энтропию идеального газа. Для этого используем первое начало термодинамики:
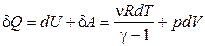 . (1.79)
. (1.79)
Подставим (1.79) в выражение, определяющее энтропию:
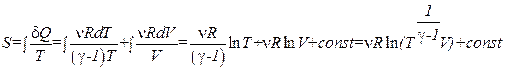 . (1.80)
. (1.80)
Это равенство также доказывает, что энтропия – функция состояния, поскольку при выводе не было сделано никаких предположений по поводу происходящего в системе процесса.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 379; Нарушение авторских прав?; Мы поможем в написании вашей работы!