
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предполагаемое 2 страница
|
|
|
|
В таком случае наиболее рациональным подходом является оксигенотерапия кислородными смесями не более 40% либо искусственная вентиляция легких в режиме гипервентиляции.
Необходимо помнить, что больные с хроническим респираторным ацидозом являются относительно компенсированными больными, где степень сопутствующего метаболического алкалоза эквипотенциальна степени гиперкапнии. При лечении респираторного ацидоза у таких больных не следует снижать CO2 ниже «нормального» для них уровня или, по крайней мере, снижать в течение суток, так как при быстрой коррекции гиперкапнии метаболический алкалоз остается «неприкрытым».
Применение щелочных растворов.
Если меры по улучшению выведения CO2 из организма не приносят существенного успеха и сохраняется значительно сниженный pH (от 7,2 и ниже), некоторые клиницисты допускают применение щелочных буферирующих растворов.
Натрия гидрокарбонат (бикарбонат).
Применение натрия гидрокарбоната (NaHCO3) в конечном итоге приводит к образованию CO2 (см. рис. 9).

Рис. 9. Механизм действия натрия гидрокарбоната в условиях респираторного ацидоза.
Реакция диссоциации угольной кислоты при дыхательном ацидозе в данном случае сдвинута влево, при введении натрия гидрокарбоната образовавшийся HCO3- буферирует H+ и препятствует этому сдвигу, направляя реакцию на повышение образования CO2. Так как уже имеющийся дыхательный ацидоз подразумевает под собой неполноценную легочную вентиляцию, то излишек образованного CO2, разумеется, значительно утяжелит гиперкапнию. Помимо того, резкое первоначальное снижение концентрации H+ при применении бикарбоната натрия вызывает обратную диссоциацию ионов водорода из не бикарбонатных буферов (back titration of the buffer). Вновь образовавшийся H+ опять взаимодействует с бикарбонатом, приводя к дополнительному увеличению CO2. Применение NaHCO3 в дозе 1 ммоль/кг вызывает увеличение CO2 на 20 мм рт. ст. Поэтому при уже имеющейся гиперкапнии (респираторном ацидозе) применение натрия гидрокарбоната без ИВЛ, обеспечивающую полноценное выведение углекислого газа, неоправданно и потенциально опасно. К тому же чрезмерное образование CO2 может привести к парадоксальному внутриклеточному ацидозу (см. рис. 8). Бикарбонат не обладает способностью проникать через клеточные мембраны, зато это успешно делает полученный в результате ощелачивающей терапии CO2, повышая кислотность в цитозоле. Образование внутриклеточного ацидоза при примени бикарбоната натрия не обязательно, но может иметь место. Как показали последние исследования, эффект ощелачивающей терапии на внутриклеточную кислотность не совсем предсказуем: pH клетки в равной мере может повышаться, снижаться либо оставаться неизменным. В проведенных на животных опытах не было выявлено никакого преимущества терапии бикарбонатом натрия перед применением солевых растворов в коррекции респираторного ацидоза. Данные обстоятельства, возможно, диктуют необходимость использовать другие буферные щелочные растворы, не содержащие бикарбонат (подробнее о NaHCO3 см. в разделе «Метаболический ацидоз»).
|
|
|
Трисамин (Тris-Hydroxymethyl AminoMethane, THAM-E)
Трисамин, в отличие от натрия гидрокарбоната, проникает через биологические мембраны, способен устранять внутриклеточный ацидоз и не повышает CO2 в крови. Обладает способностью угнетать дыхательный центр, поэтому у больных с недостаточностью функции дыхания применять его желательно, если больной находится на ИВЛ. В то же время, если больной находится на ИВЛ, то адекватно подобранный режим должен эффективно устранять дыхательный ацидоз без дополнительной медикаментозной буферной поддержки. Возможно, применять трисамин есть смысл в случаях тяжелого ацидоза для быстрой коррекции КЩС и при невозможности провести механическую гипервентиляцию. Например, при РДС-синдроме ограничение пикового давления заставляет проводить вентиляцию легких уменьшенным дыхательным объемом. Увеличивая МОД путем повышения частоты дыхания не всегда возможно эффективно выводить CO2, потому что при снижении дыхательного объема возрастает вентиляция анатомического мертвого пространства по отношению к альвеолярной вентиляции. При гиперкапнии первый шаг к повышению МОД должен начинаться с повышения дыхательного объема, при отсутствии эффекта производится увеличение частоты дыхания.
|
|
|
Если же по вышеупомянутым причинам эффективную гипервентиляцию провести невозможно, допускается сохранение гиперкапнии (пермиссивная, допустимая гиперкапния, принцип допустимого зла – accepted evil). Если уровень pH умеренно снижен, то вмешиваться в гомеостаз в таком случае не стоит. Непосредственно гиперкапния не столь опасна, как тяжелый ацидоз, который она вызывает – при РДС-синдроме допускаются цифры CO2 до 70 мм рт. ст., пороговый уровень pH должен быть не менее 7,1. В таких случаях полезно ориентироваться на общее состояние больного и, в зависимости от клинической ситуации, учитывая гемодинамические параметры, принимать индивидуальное решение по применению буферных растворов.
Попытки удалять CO2 экстракорпоральными методами не увенчались успехом, поскольку летальность и исход у больных РДС-синдромом с пермиссивной гиперкапнией не изменились.
Преимущества респираторного ацидоза
На данный момент нет информации о достоверной пользе гиперкапнии и респираторного ацидоза в целом независимо от общего преморбидного фона больного. Проведенные исследования касались только допустимой (приемлемой) гиперкапнии у больных с РДС-синдромом, являющейся следствием выбранной стратегии респираторной терапии. Как говорилось выше, стремление уменьшить пиковое давление в легких неизбежно ведет к уменьшению дыхательного объема вплоть до 6 мл/кг. В таких условиях замедленное выведение CO2 является нежелательным (скорее, незапланированным) событием, сопровождающим большинство больных с РДС-синдромом. Клинические исследования, в том числе основных гомеокинетических показателей, выявили у таких больных некоторые позитивные моменты респираторного ацидоза [5]:
|
|
|
· Гиперкапнический ацидоз снижает апоптоз пневмоцитов, уменьшая обусловленную легочной ишемией/реперфузией запрограммированную клеточную смерть;
· Респираторный ацидоз снижает повреждающую способность повышенного инспираторного давления, однако не уменьшает степень повреждения легких у больных с истощением сурфактанта;
· Возрастает органная устойчивость к гипоксии. Так, в опытах на изолированном сердце было убедительно показано, что в условиях респираторного ацидоза восстановление функциональной способности сердца после искусственной ишемии происходит быстрее; опыты на головном мозге животных доказали, что гиперкапнический ацидоз защищает нейроны от гипоксии и предотвращает нейрональный апоптоз; в условиях аноксии гепатоциты при сопутствующей гиперкапнии становятся более устойчивыми к механизмам клеточной смерти. Коррекция pH до нормальных величин в этих случаях непременно ускоряла гибель клеток.
· Респираторный ацидоз оказывает умеренный противовоспалительный эффект за счет снижения количества цитокинов, ингибирует высвобождение TNF-α и IL-1 из макрофагов, что подтверждается снижением уровня ФНО в смыве жидкости полученной путем бронхоальвеолярного лаважа у больных с СОЛП. Гиперкапния снижает экспрессию молекул адгезии нейтрофилов, предотвращая их связывание с поверхностью эндотелия, снижет внутриклеточный pH в активизированных нейтрофилах, нарушая хемотаксис и снижая их общее количество как в вентилятор-ассоциированном, так и в эндотоксин-индуцируемом повреждении легких.
· Снижение продукции свободных радикалов, играющих немаловажную роль в механизмах повреждении легких. Образование свободных радикалов увеличивается при гипокапнии и уменьшается при гиперкапнии. Способность нейтрофилов производить супероксиды в условиях респираторного ацидоза резко снижается, уменьшается перекисное окисление липидов в головном мозге. В легких свободнорадикальное окисление играет роль своеобразной защиты, однако в условиях ALI легочная защита становиться избыточной, фагоцитарная активность вызывает так называемую респираторную вспышку (respiratory burst pathway) или «дыхательный ожог». Ингибируя образование свободных радикалов, гиперкапнический ацидоз оказывает протекторное действие на легочную ткань. Немаловажную роль играет уменьшение активности ксантиноксидазы, участвующей в реперфузионном повреждении тканей путём преобразования гипоксантина в ураты, а в дальнейшем в кислородные радикалы при возобновлении оксигенации.
|
|
|
· Образование пероксинитритов меняется вариабельно. Пероксинитриты образуются в результате взаимодействия окиси азота с супероксидным радикалом и вызывают повреждение тканей из-за окисления биомолекул и взаимодействия с фенольными аминокислотными остатками в белках. В случаях искусственно вызванного СОЛП у животных гиперкапнический ацидоз снижал количество пероксинитритов, однако при эндотоксин-индуцируемом повреждении легких происходило парадоксальное увеличение пероксинитритов.
· Гиперкапнический ацидоз ингибирует эндотоксин-индуцируемую выработку NF-kB. Как известно, NF-kB регулирует образование ICAM-1, VCAM-1, IL-2, IL-6, IL-8, действуя через ядро клетки. Физиологическим ингибитором NF-kB является IkB-α (inhibitory protein-kB), уменьшение количества белка-ингибитора ведет к освобождению связанного NF-kB, облегчая его транслокацию в ядро клетки. Гиперкапнический ацидоз предотвращает связывание NF-kB с ДНК через механизм, опосредованный уменьшением элиминации IkB-α.
· Увеличение сердечного выброса наступает несмотря на ухудшение контрактильности миокарда, что связано, по-видимому, с пропорциональным снижением общего периферического сосудистого сопротивления.
Гиперкапния или ацидоз?
Защитный эффект гиперкапнического ацидоза может быть обусловлен как и гиперкапнией, так и, собственно, ацидозом. И ацидоз и гиперкапния обладают целым рядом негативных эффектов, однако окончательная оценка польза/вред может быть дана только исходя из состояния больного в целом, наличия сопутствующих патологий. Существенный позитивный эффект респираторный ацидоз оказывает благодаря уменьшению сродства гемоглобина к кислороду:
H+ + HbO2 ↔ HbH+ + O2
Сдвигая реакцию вправо, ацидоз облегчает отдачу кислорода в тканях (эффект Бора), что повышает выживаемость клеток в условиях сопутствующей гипоксии.
Однако существуют определенные состояния, когда гиперкапнический ацидоз потенциально опасен. При повышенном ВЧД гиперкапния должна быть четко контролируема, при септических состояниях с нестабильной гемодинамикой и при приёме бета-блокаторов ацидоз может спровоцировать «обвал» сердечно-сосудистой регуляции, что подтверждают опыты над животными in vivo.
Что же касается позитивного эффекта ацидоза на моделях животных со спровоцированным ишемией/реперфузией ALI, то было доказано, что нормокапнический ацидоз (т. е. метаболический) снижает степень повреждения легочной ткани, хотя и в меньшей степени, чем гиперкапнический (респираторный). Непосредственно гиперкапния без ацидоза (с нормальными цифрами pH) может вызвать повреждение клеток альвеолярного эпителия и уменьшить образование сурфактанта.
Однако необходимо чётко понимать, что позитивное действие респираторного ацидоза является строго дозозависимым, и при высоких цифрах PaCO2 все благоприятные эффекты нивелируются.
Совсем нет необходимости стремиться вызвать у всех больных на ИВЛ умеренный респираторный ацидоз, пытаясь облегчить их состояние, так как всегда наилучшими условиями лечения больного являются максимально физиологические условия; если же по вышеупомянутым причинам избежать респираторного ацидоза не предоставляется возможным, то политика невмешательства в гомеостаз должна сохраняться до тех пор, пока не будут развиваться очевидные побочные эффекты гиперкапнии и/или ацидоза.
5.2.2. МЕТАБОЛИЧЕСКИЙ АЦИДОЗ
Метаболический ацидоз развивается в результате снижения количества бикарбоната. Для этого существует несколько основных причин:
· расход бикарбоната на связывание ионов водорода, образующихся в результате диссоциации сильных нелетучих кислот:
Ø неспособность почек экскретировать метаболические кислоты, образуемые в нормальных физиологических условиях (renal failure);
Ø образование избыточного количества кислот в организме (лактат ацидоз, кетоацидоз);
Ø экзогенное поступление кислот (инфузия кислотосодержащих растворов или прием кислот внутрь (ацетилсалициловая))
· чрезмерная потеря бикарбоната через ЖКТ или мочевыделительную систему;
· относительное снижение концентрации бикарбоната вследствие разведения внеклеточной жидкости растворами, не содержащими бикарбонат (дилюционный алкалоз).
Метаболический ацидоз характеризуется изменением pH ниже 7,35 при отрицательном значении BE и нормальном уровне CO2. Концентрация SB и AB при метаболическом ацидозе будет снижена практически одинаково.
Усложнять - просто, упрощать - сложно.
Закон Мейера
Основные принципы физиологии
Многие врачи, к сожалению, являются ксенофобами, не имея к тому же достаточного желания для более углубленного изучения медицинских наук. Панически боясь новой и сложной для них информации, они аргументируют своё нежелание или неспособность обучения возрастом и нехваткой времени. Если читатель все же дошел до этого момента, то ему будет, несомненно, интересно освоить проблему КЩС на достаточно серьезном уровне. Понимание приведенных далее законов и механизмов уж точно не принесет вреда «пытливым» умам, да и как говорил Сенека старший, «лучше изучить лишнее, чем ничего не изучить». Тем же, кому детальный разбор темы заведомо неинтересен и кого откровенно пугает слово «лишнее», автор советует продолжить чтение со следующего раздела.
Итак, кислотно-щелочное состояние

Рис. 10. Диаграмма Gamble, классический вариант
тесно взаимосвязано с электролитным составом крови и эта взаимосвязь описывается законом электронейтральности. Закон электронейтральности гласит, что суммы всех катионов и суммы всех анионов плазмы равны.
Электрохимическое равновесие хорошо отражает диаграмма Гэмбла (Gamblegram) (см. рис. 10)
Сумма катионов равна сумме анионов и составляет порядка 150 мэкв/л. Основным катионом плазмы является натрий – 140 мэкв/л, основным анионом – хлор – 100 мэкв/л. Сумма бикарбоната и белка (в основном альбумина) составляет показатель BB (буферные основания). Показатель BB отражает разность основных катионов и анионов – натрия и хлора; так как оставшиеся (второстепенные) анионы и катионы примерно равны суммарному заряду, их значения можно отбросить. Тогда диаграмма примет следующий вид:
BB ≈ Na+ - Cl-
Разность между основным катионом и анионом составляет сумму количества бикарбоната и белков, в основном альбумина.
Пользуясь данным уравнением можно быстро оценить степень метаболических нарушений. Зная, что нормальные значения BB равны 40-50 ммоль/л (в данном случае допустимо мэкв/л)[8], вычисляется разность между измеренными BB и нормальными. Этой разностью будет являться величина BE:
BE = BBБОЛЬНОГО – BBНОРМА
Конечно, такой расчет является крайне приблизительным, при допустимой возможности изменения концентрации остаточных анионов (например, при нарушении функции почек) показатель BB теряет свою информативность. Применение такого расчета возможно при отсутствии полного анализа КЩС, когда есть необходимость быстро оценить нарушения кислотности, основываясь только на анализе электролитов плазмы.
Более точно определить наличие и степень тяжести метаболического ацидоза можно по значению анионной разницы.
Современные принципы КЩС
В постсоветских странах для расчета pH принято использовать традиционную модель кислотно-щелочного состояния по Гендерсону-Хассельбальху, разработанную еще в начала прошлого века. Такая модель является частным случаем, рассматривающим изменения кислотности в среде без белков и фосфата, то есть в ней не учитывается концентрация слабых кислот (ATOT). В таком случае должна наблюдаться линейная зависимость отношения pH к PaCO2. На практике такой зависимости не выявляется, что обусловлено действием неучтенных слабых кислот, в частности альбумина и фосфатов. Надо полагать, что применение в клинической практике формулы Гендерсона-Хассельбальха по этой причине должно быть существенно ограничено.
Модель Стюарта
Канадский физиолог Stewart еще в середине 80-х годов создал новую модель расчета pH, полагая, что игнорирование значений ATOT в уравнении Henderson-Hasselbalch потенциально ошибочно.
Согласно Stewart, расчет концентрации ионов водорода производится следующим образом[9]:
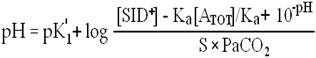
Где pK'1 – константа диссоциации для бикарбонатного буфера, [SID+] – разница сильных ионов (см. далее), Ka - константа диссоциации для слабых кислот, ATOT – концентрация слабых кислот, S – коэффициент растворимости для CO2.
Как видно из уравнения, корреляция между pH и PaCO2 изменяется в зависимости от концентрации белка (ATOT) или сильных анионов (Na+ или Cl- - SID+) и становится нелинейной при развитии отклонений кислотности.
Так как разница сильных ионов (SID+) отражает концентрацию бикарбоната и слабых кислот (альбумин и фосфат), то если ATOT = 0, данное уравнение примет вид хорошо известного уравнения Гендерсона-Хассельбальха, где в числителе будет HCO3-, а в знаменателе PaCO2.
Однако когда концентрация ATOT варьирует, упрощение традиционной КЩС-модели неоправданно. Несовершенство модели Гендерсона-Хассельбальха в частности приводит к тому, что ацидоз вследствие потерь бикарбоната выглядит так же, как и ацидоз вследствие поступления анионов.

Рис. 11. Независимые переменные Стюарта и их влияние на КЩС. K'w – константа диссоциации для воды.
Согласно Стюарту, на концентрацию H+ и HCO3- оказывают влияние три независимые переменные – SID+, ATOT, PaCO2 (см. рис. 11). Контроль всех переменных осуществляется с помощью регуляторных систем организма, представленных на графической модели Стюарта (см. рис. 13)
Разница сильных ионов – SID+ (strong ion difference).
Разница сильных ионов рассчитывается следующим образом:
[SID+]a = [Na+] + [K+] – [Cl-] – [лактат] – [другие сильные анионы]
Разница сильных ионов показывает остаток неучтенных ионов – бикарбоната и диссоциирующих слабых кислот [A-].
В отличие от слабых ионов, сильные ионы практически полностью подвергаются диссоциации в водном растворе и фактически не вступают в химические реакции. Поэтому значение SID является независимой постоянной, влияющей на количество воды, подвергшейся диссоциации на H+ и OH-, то есть является основным определяющим критерием pH.
При повышении значения [SID+]a pH сдвигается в щелочную сторону, так как разница сильных ионов показывает остаток бикарбоната и слабых кислот. Бикарбонат обладает большей степенью воздействия на pH, в отличие от слабых кислот, поэтому при повышении [SID+]a наблюдается алкалоз, при снижении – ацидоз.
В нормальных условиях [SID+]a (apparent, очевидная разница) равна показателю [SID+]е (effective).
[SID+]e = [HCO3-] + [A-]
Где [A-] – концентрация диссоциирующих слабых кислот, преимущественно альбумина и фосфата.
Верно, что при не нарушенном гомеостазе [SID+]a = [SID+]e, то есть:
[Na+] + [K+] – [Cl-] – [лактат] – [другие сильные анионы] = [HCO3-] + [A-]
Если значения [SID+]a и [SID+]e становятся различными, то их разность выражается значением SIG (strong ion gap).
Промежуток сильных ионов - SIG (strong ion gap) полезен для идентификации неизмеряемых ионов.
SIG = [SID+]a - [SID+]e
или
SIG = [Na+] + [K+] – [Cl-] – [лактат] – [другие сильные анионы] – ([HCO3-] + [A-])
Преобразуем уравнение и получим:
SIG = [Na+] + [K+] – [Cl-] – [лактат] – [другие сильные анионы] – [HCO3-] - [A-]
Количество лактата и других сильных анионов в норме минимально, поэтому уравнение можно упростить, тогда SIG равен:

[Na+] + [K+] – [Cl-] – [HCO3-] - [A-]
Выделенная рамкой часть и есть вышеупомянутая анионная разница. Таким образом, получаем следующую зависимость:
SIG = AG - [A-]
Промежуток сильных ионов является лучшим индикатором неизмеряемых анионов, чем анионная разница. В отличие от анионной разницы, значение SIG в норме равно нулю. Но, например, в плазме с низким уровнем альбумина SIG может быть повышен (при наличии неизмеряемых анионов) даже если анионная разница не изменена. В таком случае ощелачивающий эффект гипоальбуминемии маскирует присутствие неизмеряемых анионов.

Рис. 12. Диаграмма Gamble, современный вариант, with changes and additions by Kostuchenko S. S. 2008
На рис. 12 проиллюстрировано взаимоотношение SIG, [SID+]a, [SID+]e и анионной разницы. При неизмененном уровне бикарбоната SIG может возрастать при условии снижения [A-]. В таком случае произойдет перераспределение компартментов, которые включает в себя анионная разница (см. рис.12). Будет наблюдаться вышеописанный случай снижения [A-] за счет уменьшения количества альбуминов, но если произойдет параллельное увеличение неизмеряемых анионов (SIG), то общее значение анионной разницы останется неизменным. При увеличении значения SIG будет происходить снижение [SID+]e. Поэтому растущая величина SIG на диаграмме Gamble свидетельствует о наличии неизмеряемых анионов даже при нормальных значениях анионной разницы.
Как упоминалось выше, уравнение Гендерсона-Хассельбальха не позволяет отличить истинную причину ацидемии, будь это либо расход бикарбоната, либо увеличение количества неизмеряемых анионов.
Когда количество нелетучих кислот не увеличено, разница между [SID+]a, [SID+]e соответствует значению BE, однако при изменении концентрации нелетучих кислот такая зависимость пропадает. Поэтому вычисленное значение BE по стандартным номограммам не может адекватно отражать физиологический статус организма при вариабельности переменных Стюарта (в частности SID+, ATOT).
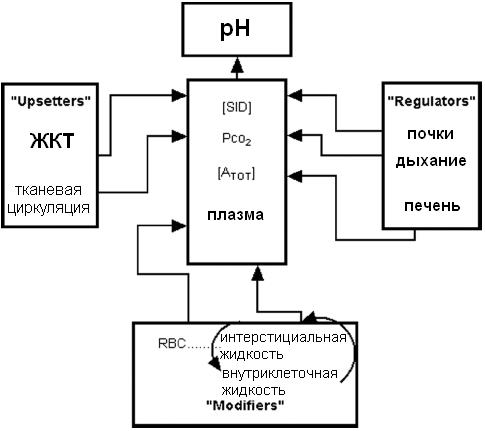
Рис. 13. Модель Стюарта. Представлены основные постоянные – [SID+], [ATOT], PaCO2 и их зависимость от функциональных регуляторов организма.
Уравнение Figge-Fencl
Как описывалось в уравнении Стюарта, [ATOT] является общей концентрацией слабых кислот, преимущественно альбумина. Однако альбумин обладает сложной структурой, включающей в себя порядка 212 аминокислот, каждая из которых способна вступать в реакции с H+. Константа диссоциации аминокислот (pKa) варьирует, для 178 аминокислот показатель pKa не вписывается в нормальные значения pH. Как результат, 99 аминокислот имеют закрепленный (фиксированный) отрицательный заряд (в основном аспартат и глутамат) и около 79 аминокислот имеют стабильный положительный заряд (в основном аргинин и лизин). Суммарно чистый отрицательный заряд превалирует и составляет около 21 мэкв/л. Помимо этого, альбумин содержит 16 гистидиновых остатков, которые, благодаря имидазольным группам, могут взаимодействовать с ионами водорода.
Уравнение Figge-Fencl учитывает вклад в общий электрический заряд каждой аминокислоты и гистидинового остатка молекулы альбумина и рассчитывает каждый из показателей ATOT в отдельности:
[SID+]e = [HCO3-] + [Pix-] – [Pry-]
Где [Pix-] – суммарный заряд фосфатов,
[Pry-] – суммарный заряд альбумина (в мэкв/л).
Минуя громоздкие расчеты, получим в итоге следующее уравнение:
SIG = AG – [альбумин (г/дл)] (1,2 × pH – 6,15) + [фосфат (мг/дл)] (0,097 × pH – 0,13)
Исходя из уравнения Figge-Fencl, когда pH = 7,40 анионная разница будет повышаться на 2,5 мэкв/л в ответ на каждое снижение альбумина на 1 г/дл;
или
AGCORR. = AGCALC. + 2,5 × (4,4 – A)
где AGCORR – откорректированное значение анионной разницы, AGCALC. – первоначально рассчитанное значение анионной разницы, А – уровень альбумина в г/дл.
Буферная величина (buffer value) –
определяется соотношением Δbase/ΔpH и вычисляется по формуле:
β = 1,2 × [альбумин (г/дл)] + 0,097 × [фосфат (мг/дл)]
При сниженных значениях β показатель ΔpH будет выше при любом значении BE, чем когда β в норме. То есть при снижении β будет наблюдаться ацидоз, в устранении которого будет задействованы не только бикарбонатный, но и другие буферы плазмы. Используя данный подход, в отличие от классической модели, можно более точно предсказать изменения количества бикарбоната при развитии ацидоза. Показатель β является ключевым параметром, который связывает различные компоненты моделей Henderson-Hasselbalch, Stewart и Figge-Fencl воедино. Когда некарбонатные буферы не изменены,
BE = Δ[SID+] e = Δ[HCO3-] + βΔpH
Когда концентрация некарбонатных буферов варьирует, BE = Δ[SID+] e', таким образом, [SID+]a будет соотнесено с новой концентрацией слабых буферов.
Таблица 5. Состояния, классифицированные согласно методу Стюарта
| КЩС-расстройство | Признаки | Причины |
| Метаболический алкалоз | Гипоальбуминемия | Нефротический синдром, хронический гепатит |
| Высокий SID+ | Потеря хлоридов: рвота, назогастральный зонд, диуретики, хлортеряющая диарея, избыток минералокортикоидов, синдром Кушинга, синдром Лиддла, синдром Барттера, терапия ГКС, потребление лакрицы. | |
| Метаболический ацидоз | Низкий SID+ и высокий SIG | Кетоацидоз, лактат ацидоз, отравление салицилатами, метанолом, формиатом. |
| Низкий SID+ и низкий SIG | Почечный канальцевый ацидоз, полное парентеральное питание, прием анионных обменных смол, диарея, потеря панкреатического секрета (свищи и т. п.). |
Применение модели Стюарта на практике. Клинические примеры.
Контроль. Нормальная плазма определяется следующими параметрами:
pH = 7,40, PaCO2 = 40 мм рт. ст., HCO3- = 24,2 ммоль/л, альбумин = 4,4 г/дл, фосфаты = 4,3 мг/дл, натрий = 140 мэкв/л, калий = 4 мэкв/л, хлориды = 105 мэкв/л. В таблице 6 приведены основные расчетные показатели по методу Стюарта, выведенные исходя из нормальных констант плазмы.
Таблица 6. Применение теории Стюарта на практике
| Параметр, мэкв/л | Контроль | Пример 1 | Пример 2 |
| BE | -10 | -10 | |
| AG | 14,8 | 14,8 | 14,8 |
| [SID+]a | |||
| [SID+]e | 20,7 | ||
| SIG | 8,3 | ||
| β | 5,7 | 5,7 | 2,2 |
| BECORRECTED | -10,6 | -10,2 |
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1744; Нарушение авторских прав?; Мы поможем в написании вашей работы!