
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эффект Джоуля-Томсона
|
|
|
|
Семинар 5. Внутренняя энергия газа Ван-дер-Ваальса.
Ответы
Задачи

4.1. Записать уравнение Ван-дер-Ваальса (21) для газа, содержащего 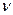 молей.
молей.
4.2. Рассчитать критические параметры pk, Vk, Tk двумя способами, учитывая, что для критического состояния уравнение (21) имеет вид (V-Vкр)3=0.
4.3. Записать уравнение Ван-дер-Ваальса в приведенных параметрах
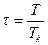 ,
,  ,
, 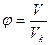 ,
,
т.е. таких параметрах, когда за единицы приняты критическая температура, критическое давление и критический объем моля газа.
 4.4. Найти приращение энтропии одного моля ван-дер-ваальсовского газа при изотермическом изменении его объема от V1 до V2.
4.4. Найти приращение энтропии одного моля ван-дер-ваальсовского газа при изотермическом изменении его объема от V1 до V2.
|
4.1. 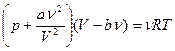 ;
;
4.3. 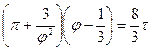 ;
;
4.4  .
.

Исследования Джоуля и Томсона позволили не только экспериментально подтвердить зависимость внутренней энергии реального газа от его объема. Было открыто важное физическое явление, получившее название эффекта Джоуля-Томсона.
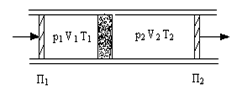
В опыте использовалась теплоизолированная трубка, разделенная пористой перегородкой, по обе стороны от которой находился газ (рис.19). Газ под действием разности давлений медленно протекал через перегородку, при помощи поршней П1, П2. До перегородки и после нее газ находился в термодинамически равновесных состояниях. Давление p1, p2 по разные стороны перегородки поддерживалось постоянным.
Стационарное течение газа через пробку называется процессом Джоуля-Томсона, а изменение температуры газа при таком течении – эффектом Джоуля-Томсона.
Процесс Джоуля-Томсона необратимый, он происходит при постоянной энтальпии:
 .
.

При достаточно низкой температуре газ при расширении охлаждается,  - отрицательный эффект Джоуля-Томсона; при достаточно высокой температуре газ при расширении нагревается,
- отрицательный эффект Джоуля-Томсона; при достаточно высокой температуре газ при расширении нагревается, 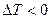 - положительный эффект Джоуля-Томсона. Температура, при которой
- положительный эффект Джоуля-Томсона. Температура, при которой 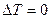 , т.е. происходит изменение знака эффекта Джоуля-Томсона, называется температурой инверсии.
, т.е. происходит изменение знака эффекта Джоуля-Томсона, называется температурой инверсии.
|
|
|
Эффект Джоуля-Томсона имеет очень важное практическое значение: наряду с адиабатическим расширением этот эффект используется для получения низких температур.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1017; Нарушение авторских прав?; Мы поможем в написании вашей работы!