
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
Химическое равновесие – состояние системы, при которой скорость прямой реакции равно скорости обратной.
Факторы, влияющие на смещение химического равновесия:
1) концентрация веществ;
2) температура;
3) давление (для газов).
1. Влияние концентрации
Повышение концентрации одного из реагентов смещает равновесие в сторону прямой реакции, понижение концентрации одного из реагентов смещает равновесие в сторону обратной реакции.
2. Влияние температуры
При повышении температуры химическое равновесие смещается в сторону эндотермической реакции; при понижении температуры – в сторону экзотермической реакции.
Экзотермическая реакция – реакция, идущая с выделением теплоты (∆H<0); эндотермическая – с поглощением теплоты (∆H>0).
3. Влияние давления
Повышение давления смещает равновесие в сторону уменьшения объема реагирующей системы (в сторону меньшего числа частиц); понижение давления смещает равновесие в сторону увеличения объема реагирующей системы (в сторону большего числа частиц). Если число молей продуктов реакции равно число молей исходных веществ, то изменение давления не влияет на положение химического равновесия.
Пример 1. Указать влияние различных факторов на смещение химического равновесия для реакции:
N2(г) + 3H2(г) = 2NH3(г), ∆Н<0 – экзотермическая реакция
Решение:
а) повышение концентрации водорода или азота смещает химическое равновесие в сторону образования аммиака;
б) понижение концентрации водорода или азота – равновесие смещается влево;
в) при повышении температуры равновесие смещается в сторону эндотермической реакции, т.е. влево;
г) при понижении ТЕМПЕРАТУРЫ равновесие смещается в сторону экзотермической реакции, т.е. вправо;
|
|
|
д) при повышении давления равновесие смещается в сторону меньшего числа молей газообразных веществ в системе, т.е. вправо;
е) при понижении давления равновесие смещается в сторону большего числа молей газообразных веществ в системе, т.е. влево.
В случае обратимой химической реакции
А + В 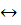 С + D
С + D
Зависимость скоростей прямой (υ→) и обратной (υ←) реакций от концентраций реагирующих веществ выражается соотношениями:
υ→ = k→[A][B];
υ← = k←[С][D].
В состоянии химического равновесия υ→ = υ←, т.е. k→[A][B] = k←[С][D]. Отсюда:
k→/ k← = 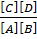 = К,
= К,
где К – константа равновесия реакции.
Концентрации, входящие в выражении константы равновесия, называются равновесными концентрациями. Константа равновесия – постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т.е. тем больше выход ее продуктов.
В химической термодинамике доказывается, что для общего случая химической реакции
аА + bB + … ↔ cC + dD + …
справедливо аналогичное выражение для константы равновесия реакции:
К =  .
.
В выражении константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются постоянными. Катализатор не влияет на значение константы равновесия. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Пример 2. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны:
[A]=0,06 моль/л; [B]=0,12 моль/л; [C]=0,216 моль/л.
Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение:
1. Константа равновесия равна
|
|
|
k= 
k=0,216/0,06∙0,122=2,5
2. Согласно уравнению реакции, из 1 моля А и 2 моля В образуется 1 моль С. Так как по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216∙2=0,432 моля В.
Таким образом, исходные концентрации равны:
[A0] = 0,06 + 0,216 = 0,276 моль/л;
[B0] = 0,12 + 0,432 = 0,552 моль/л.
Вариант 1
1. Во сколько раз изменится скорость реакции 2А+В→А  В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
2. Как изменится скорость реакции 2NO (г.)+О  (г.)→2NO
(г.)→2NO 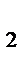 (г.), если: а) увеличить давление в системе в 3 раза; б) повысить концентрацию NO в 3 раза?
(г.), если: а) увеличить давление в системе в 3 раза; б) повысить концентрацию NO в 3 раза?
3. Две реакции протекают при 25 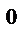 С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй – 2,5. Найти отношение скоростей этих реакций при 95
С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй – 2,5. Найти отношение скоростей этих реакций при 95 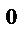 С.
С.
4. Как изменится скорость химической реакции при увеличении температуры от 50 до 90 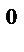 С, если температурный коэффициент реакции равен 2?
С, если температурный коэффициент реакции равен 2?
5. В какую сторону сместится равновесие в системе 2А(газ)+В(газ) 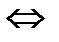 2С(газ.),
2С(газ.),  Н<0, если а) увеличить давление; б) уменьшить концентрацию вещества А?
Н<0, если а) увеличить давление; б) уменьшить концентрацию вещества А?
____________________________________________________________
Вариант 2
1. Во сколько раз изменится скорость реакции 2А+В→А 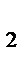 В, если концентрацию вещества А увеличить в 4 раза, а концентрацию вещества В уменьшить в 3 раза?
В, если концентрацию вещества А увеличить в 4 раза, а концентрацию вещества В уменьшить в 3 раза?
2. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 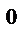 С скорость реакции возрастает в 15,6 раза?
С скорость реакции возрастает в 15,6 раза?
3. Как изменится скорость химической реакции при уменьшении температуры от 80 до 20 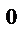 С, если температурный коэффициент реакции равен 3?
С, если температурный коэффициент реакции равен 3?
4. В какую сторону сместится равновесие в системе А(газ)+В(газ) 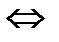 2С(газ.),
2С(газ.),  Н<0, если а) увеличить концентрацию вещества А; б) уменьшить давление?
Н<0, если а) увеличить концентрацию вещества А; б) уменьшить давление?
5. При состоянии равновесия в системе
N 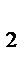 (г.)+3Н
(г.)+3Н 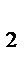 (г.)
(г.) 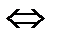 2NH
2NH 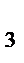 (г.);
(г.); 

 Н
Н 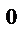 =−92,4 кДж
=−92,4 кДж
концентрации участвующих веществ равны:  [N
[N 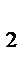 ]=3 моль/л; [Н
]=3 моль/л; [Н 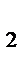 ]=9 моль/л; [NH
]=9 моль/л; [NH 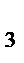 ]=4 моль/л. Определить: а) исходные концентрации Н
]=4 моль/л. Определить: а) исходные концентрации Н 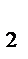 и N
и N 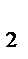 ; б) в каком направлении сместится равновесие с ростом температуры; в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
; б) в каком направлении сместится равновесие с ростом температуры; в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
______________________________________________________________
Вариант 3
1. Во сколько раз изменится скорость реакции А+2В→АВ2, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 4 раза?
|
|
|
2. Как изменится скорость химической реакции при уменьшении температуры от 50 до 20 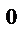 С, если температурный коэффициент реакции равен 4?
С, если температурный коэффициент реакции равен 4?
3. Указать, каким образом можно сместить равновесие реакции вправо
СО 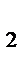 (газ)+С(тв.)
(газ)+С(тв.) 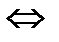 2СО(газ),
2СО(газ),  Н<0
Н<0
4. В каком направлении сместится равновесие
2CO (газ)+O 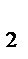 (газ)
(газ) 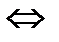 2СO
2СO 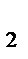 (газ);
(газ);  Н
Н 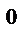 =−566 кДж
=−566 кДж
а) при понижении температуры;
б) при повышении давления?
5. Равновесие в системе Н 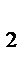 (газ)+I
(газ)+I 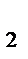 (газ)
(газ) 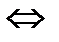 2HI (газ) установилось при следующих концентрациях: [Н
2HI (газ) установилось при следующих концентрациях: [Н 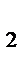 ]=0,025 моль/л; [I
]=0,025 моль/л; [I 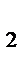 ]=0,005 моль/л; [НI]=0,09 моль/л. Определить исходные концентрации иода и водорода.
]=0,005 моль/л; [НI]=0,09 моль/л. Определить исходные концентрации иода и водорода.
Вариант 4
1. Во сколько раз изменится скорость реакции 2А+В→А2В, если концентрацию вещества А уменьшить в 4 раза, а концентрацию вещества В увеличить в 2 раза?
2. Как изменится скорость химической реакции при уменьшении температуры от 40 до 200С, если температурный коэффициент реакции равен 3?
3. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30  С скорость реакции возрастает в 15,6 раза?
С скорость реакции возрастает в 15,6 раза?
4. В какую сторону сместится равновесие в системе 2А(тв.)+В(газ) 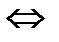 2С(газ.),
2С(газ.),  Н>0, если а) уменьшить температуру; б) увеличить давление?
Н>0, если а) уменьшить температуру; б) увеличить давление?
5. При 120 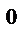 С некоторая реакция заканчивается за 15 мин. Принимая температурный коэффициент скорости реакции равным 3, рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 150
С некоторая реакция заканчивается за 15 мин. Принимая температурный коэффициент скорости реакции равным 3, рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 150 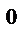 С; б) при 50
С; б) при 50 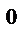 С.
С.
______________________________________________________________
Вариант 5
1. Во сколько раз изменится скорость реакции А+2В→АВ2, если концентрацию вещества А увеличить в 4 раза, а концентрацию вещества В уменьшить в 2 раза?
2. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 40 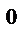 С скорость реакции возрастает в 81 раза?
С скорость реакции возрастает в 81 раза?
3. Как изменится скорость химической реакции при уменьшении температуры от 50 до 20 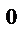 С, если температурный коэффициент реакции равен 4?
С, если температурный коэффициент реакции равен 4?
4. В каком направлении сместится равновесие
2Н 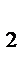 (газ)+О
(газ)+О 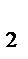 (газ)
(газ) 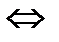 2Н
2Н 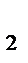 О (газ),
О (газ),  Н
Н 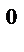 =−483,6 кДж
=−483,6 кДж
а) при повышении давления;
б) при повышении температуры.
5. Найти значение константы скорости реакции А+В→АВ, если при концентрациях веществ А и В, равных соответственно 0,07 и 0,04 моль/л, скорость реакции равна 5,6∙10 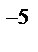 моль/(л∙мин).
моль/(л∙мин).
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 1850; Нарушение авторских прав?; Мы поможем в написании вашей работы!