
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимосвязь между внутренней энергией, теплотой и работой. Применение первого закона термодинамики к химическим реакциям
Э
Ч
Ц
Х
Ф
У
Т
С
Р
П
О
Н
М
Л
К
И
Е
Д
Г
В
Величина газовой постоянной зависит от рода газа
Величина обратная плотности газа удельный объем
Величина обратная удельному объему газа плотность
Величина, которая остается постоянной в политропном процессе: теплоемкость
Газ, используемый, как рабочее тело в парокомпрессионных холодильных машинах: аммиак
Газ, свойства которого при нормальных условиях наиболее значительно отклоняются от законов идеальных газов: Н2О
Газ, свойства которого при нормальных условиях наилучшим образом соответствуют законам идеальных газов: Не
Газовая постоянная – работа, которую совершает 1кг газа при увеличении его температуры на 1К в процессе изобарном
Газовая постоянная любого газа рассчитывается из соотношения: R = μR/μ, где μR универсальная газовая постоянная
Газовая постоянная рассчитывается из соотношения: R = μR/μ, где μ молярная масса
Газовая постоянная смеси газов определяется по уравнению: Rсм = 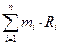 , где: mi – массовая доля компонента
, где: mi – массовая доля компонента
Давление компонента смеси при условии, что он занимает объем смеси при температуре смеси: парциальное
Диаграмму d – H влажного воздуха предложил Рамзи
Единица измерения абсолютной (термодинамической) температуры Кельвин
Единица измерения количества теплоты и работы в системе СИ: Джоуль.
Единица измерения удельной энтропии: Дж/кг К
Запись химической реакции с указанием теплового эффекта реакции – термохимическое уравнение
Изменение температуры реального газа в процессе дросселирования определяется по формуле: Т2 – Т1 = 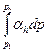 , где: αh – дифференциальный дроссель-эффект
, где: αh – дифференциальный дроссель-эффект
Изменение температуры реального газа в процессе дросселирования определяется по формуле: Т2 – Т1 = 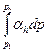 , где: Т2 – Т1 – интегральный дроссель-эффект
, где: Т2 – Т1 – интегральный дроссель-эффект
Источник теплоты в тепловом насосе: окружающая среда
Кажущаяся молярная масса смеси определяется по уравнению: μсм = 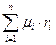 , где μi – молярная масса компонента
, где μi – молярная масса компонента
Кажущаяся молярная масса смеси определяется по уравнению: μсм = 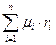 , где ri – объемная доля компонента
, где ri – объемная доля компонента
Калорическими параметрами состояния являются: энтальпия, энтропия
Канал, в котором увеличивается скорость движущегося газа при одновременном уменьшении давления – сопло
Канал, в котором уменьшается скорость движущегося газа при одновременном увеличении давления – диффузор
Количество независимых параметров, необходимых для характеристики состояния сухого насыщенного пара: 1
Количество независимых параметров, необходимых для характеристики состояния перегретого пара: 2
Количество теплоты, выделяемое (поглощаемое) системой при наличии в ней химической реакции (Т, р =const) – тепловой эффект реакции
Количество теплоты, которое рабочее тело холодильной машины отбирает от охлаждаемых предметов холодопроизводительность
Количество теплоты, подведенное к газу в термодинамическом процессе, определяется по формуле: Q = M·cm·(t2 – t1), где М – масса
Количество теплоты, подведенное к газу в термодинамическом процессе, определяется по формуле: Q = M·cm·(t2 – t1), где cm - теплоемкость: массовая средняя
Количество энергии, передаваемой в результате теплообмена теплота
Комбинация суживающегося и расширяющегося каналов – сопло: Лаваля
Кпд паросиловой установки повышается, если понижается давление пара: в конденсаторе
Критическая скорость устанавливается в наиболее узком сечении сопла
Лаваля в диапазоне перепадов давления β = р2/р1: 0< β < β кр
Линия КN на рисунке – верхняя пограничная кривая
Линия ОК на рисунке – нижняя пограничная кривая
Математическое выражение второго закона термодинамики для необратимого равновесного процесса: ds > 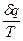
Математическое выражение второго закона термодинамики для обратимого равновесного процесса: ds = 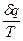
Математическое выражение закона Дальтона: рсм = 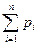 , где рi – парциальное давление компонента:
, где рi – парциальное давление компонента:
Математическое выражение первого закона термодинамики для адиабатного процесса: ∆U = –L
Математическое выражение первого закона термодинамики для изотермного процесса процесса: Q = L
Математическое выражение первого закона термодинамики для изохорного процесса: ∆U = Q
Мера интенсивности хаотического движения микрочастиц абсолютная температура
Наибольшая теплота отводиться от компримируемого газа, если процесс сжатия: изотермный
Наименьшая работа на привод компрессора затрачивается, если процесс сжатия: изотермный
Общая количественная мера для всех форм движения материи энергия.
Объемный кпд поршневого компрессора рассчитывается по формуле λv = 1 – a ( –1), где: a – относительная величина мертвого пространства
–1), где: a – относительная величина мертвого пространства
Объемный кпд поршневого компрессора рассчитывается по формуле λv = 1 – a ( –1), где: β – степень повышения давления
–1), где: β – степень повышения давления
Объемный кпд поршневого компрессора рассчитывается по формуле λv = 1 – a ( –1), где: np – показатель политропы процесса: расширения
–1), где: np – показатель политропы процесса: расширения
Отношение абсолютной влажности воздуха к максимально возможной при данных значения температуры и давления: относительная влажность
Отношение количества теплоты в бесконечно малом термодинамическом процессе к изменению температуры в этом процессе – полная истинная теплоемкость:
Отношение массовых теплоемкостей газа в изобарном и изохорном процессах это: показатель адиабаты
Отношение массы водяного пара к массе сухого воздуха, содержащейся в том же объеме влажного воздуха: влагосодержание
Отношение массы водяного пара к объему влажного воздуха – абсолютная влажность
Отношение массы компонента к массе смеси – массовая доля
Отношение массы сухого насыщенного пара к массе влажного пара – степень
Отношение парциального объема компонента к объему смеси – объемная доля
Отношение холодопроизводительности к работе, затрачиваемой холодильной машиной: холодильный коэффициент
Пар, температура которого больше температуры насыщения при данном давлении – перегретый
Параметр состояния, величина которого в политропном процессе не изменяется, если n = 1: температура
Параметр состояния, величина которого в политропном процессе не изменяется, если n = 0: давление
Параметр состояния, величина которого в политропном процессе не изменяется, если n = k: энтропия
Параметр состояния, изменение которого происходит только под действием энергии, передаваемой в виде теплоты: энтропия
Параметр, величина которого не изменяется при дросселировании идеального газа: температура
Параметр, величина которого не изменяется при дросселировании реального газа или пара: энтальпия
Параметр, величина которого увеличивается при переходе термодинамической системы из менее вероятного состояния в более вероятное энтропия
Параметр, величина которого увеличивается при фазовом переходе из жидкого состояния в газообразное: удельный объем
Параметр, величина которого увеличивается при фазовом переходе из твердого состояния в жидкое: энтропия
Параметр, изменение которого свидетельствует о подводе (отводе) теплоты: энтропия
Параметр, изменение которого свидетельствует о совершении работы: удельный объем
Параметр, не изменяющийся в процессе подвода теплоты в цикле Ренкина: давление
Передача теплоты от отработавших газов к сжатому воздуху, подаваемому в камеру сгорания ГТУ регенерация
Передача энергии в результате макроскопического, упорядоченного, направленного движения работа
Передача энергии в результате обмена хаотическим, ненаправленным движением микрочастиц теплообмен
Перепад давлений (р2/р1), при котором скорость истечения газа из суживающегося сопла равна местной скорости звука – критический
Площадь под линией процесса в s – T диаграмме численно равна: теплоте процесса;
Площадь под линией процесса в v – p диаграмме численно равна: работе процесса
Площадь прямоугольника а-в-с-d на рисунке это – удельная теплота парообразования
Показания «мокрого» и сухого термометров психрометра равны, если: относительная влажность равна 100%.
Полное давление смеси равно сумме парциальных давлений компонентов – это закон: Дальтона
Получение водяного пара в котельных установках происходит при условии постоянства: давления
Прибор для измерения избыточного давления манометр
Произведение ρ·vравно 1
Промышленные паросиловые установки работают по циклу: Ренкина
Процесс «в – с» на рисунке – изотермно изобарный
Процесс идеального газа, в котором изменение внутренней энергии равно нулю – изотермный
Процесс идеального газа, в котором не совершается (затрачивается) работа – изохорный
Процесс отвода теплоты в теоретических циклах ДВС: изохорный
Процесс отвода теплоты в цикле ГТУ: изобарный
Процесс отвода теплоты в цикле Ренкина – изобарно - изотермный
Процесс парообразование характеризует тем, что в нем не изменяется температура и – давление
Процесс парообразования характеризуется тем, что в нем не изменяется давление и – температура
Процесс парообразования характеризуется тем, что уменьшается: плотность
Процесс подвода теплоты в цикле Дизеля: изобарный
Процесс подвода теплоты в цикле Карно: изотермный
Процесс понижения давления в движущемся потоке газа при прохождении его через препятствие: дросселирование
Процесс расширения и сжатия рабочего тела в двигателе Стирлинга: изотермный
Процесс расширения пара в цикле Ренкина: адиабатный
Процесс реального газа, в котором подведенная теплота рассчитывается по формуле: q = h2 – h1 : изобарный
Процесс реального газа, в котором подведенная теплота рассчитывается по формуле: q = Т(s2 – s1): изотермный
Процесс сжатия рабочего тела в теоретических циклах ДВС: адиабатный
Процесс сжатия рабочего тела в цикле Карно: адиабатный
Процесс, в котором вся подведенная к рабочему телу теплота превращается в работу изотермный
Процесс, в котором изменение внутренней энергии газа равно подведенной (отведенной) теплоте – изохорный
Процесс, в котором изменение энтальпии газа равно подведенной (отведенной) теплоте: изобарный
Процесс, в котором изменение энтропии равно нулю: адиабатный
Процесс, в котором отсутствует теплообмен рабочего тела с окружающей средой – адиабатный
Процесс, в котором работа совершается за счет убыли внутренней энергии рабочего тела – адиабатный
Процесс, в котором теплоемкость рабочего тела равна нулю: адиабатный
Процесс, график которого в s - T диаграмме – отрезок вертикальной прямой – адиабатный
Процесс, график которого в s - T диаграмме – отрезок горизонтальной прямой – изотермный
Процесс, график которого в v - p диаграмме – отрезок вертикальной прямой –
Процесс, график которого в v - p диаграмме – отрезок горизонтальной прямой – изобарный
Процесс, графическое изображение которого в v – p диаграмме это равнобокая гипербола – изотермный
Работа газа в проточной системе, не связанная с деформацией системы – техническая работа
Работа, которую совершает 1кг газа в изобарном процессе, при увеличении температуры на 1 К газовая постоянная
Рабочее тело в цикле Ренкина: водяной пар
Рабочее тело для теплового насоса: фреон
Равенство, справедливое для механической смеси газов: 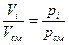 , где Vi – парциальный объем компонента
, где Vi – парциальный объем компонента
Равенство, справедливое для механической смеси газов: 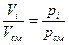 , где рi – парциальное давление компонента
, где рi – парциальное давление компонента
Разность массовых теплоемкостей идеального газа в изобарном и изохорном процессах численно равна: газовой постоянной
Разность между абсолютным и барометрическим давлением избыточное давление
Разность молярных теплоемкостей газа в изобарном и изохорном процессах численно равна: универсальной газовой постоянной
Разность энтальпий сухого насыщенного пара и насыщенной жидкости – удельная теплота парообразования
Расход газа через суживающееся сопло остается неизменным в диапазоне перепадов давления β = р2/р1: β < β кр
Расход газа через суживающееся сопло увеличивается в диапазоне перепадов давления β = р2/р1: β кр< β <1
Расчеты процессов с влажным воздухом выполняют, полагая, что, содержащийся в нем водяной пар: идеальный газ
Реальный газ в состоянии близком к состоянию насыщения – пар
Сверхзвуковая скорость истечения на выходе из сопла Лаваля достигается в диапазоне перепадов давления β = р2/р1: 0< β < β кр
Свойства реальных газов отклоняются от законов идеальных газов тем заметнее, чем больше их: плотность
Свойства реальных газов тем ближе к свойствам идеальных газов, чем больше их: удельный объем
Система, состоящая из одного или нескольких компонентов, находящихся в одной и той же фазе – гомогенная
Система, состоящая из одного или нескольких компонентов, находящихся в разных фазах – гетерогенная
Смесь кипящей жидкости и сухого насыщенного пара – влажный насыщенный пар
Смесь сухого воздуха и перегретого водяного пара – ненасыщенный влажный воздух
Смесь сухого воздуха и сухого насыщенного водяного пара – насыщенный влажный воздух
Совокупность макроскопических тел, являющаяся объектом термодинамического анализа термодинамическая система
Соотношение между абсолютной температурой (Т) и температурой по стоградусной шкале(t) T = t +273.15
Соотношение параметров pv = const справедливо для процесса: изотермного
Соотношение параметров pvk = const справедливо для процесса: адиабатного
Соотношение параметров pvn = const справедливо для процесса: политропного
Соотношение параметров в изобарном процессе: v2/v1 = T2/T1
Соотношение параметров в изотермном процессе: p2/p1 = v1/v2
Соотношение параметров в изохорном процессе: р2/р1 = T2/T1
Состояние влажного насыщенного пара обычно характеризует давление и степень сухости
Состояние рабочего тела перед турбиной промышленной паросиловой установки: перегретый пар
Состояние рабочего тела, в котором изменяется знак дифференциального дроссель-эффекта: точка инверсии
Состояние реального газа качественно характеризует уравнение состояния: Ван-дер-Ваальса
Сумма внутренней энергии и потенциальной энергии давления (pv): энтальпия
Сумма избыточного и барометрического давления абсолютное давление
Температура, выше которой, невозможно одновременное существование жидкой и газообразной фазы – критическая
Тепловой насос отбирает теплоту от окружающей среды в процессе: испарения
Теплоемкость газа в изохорном процессе можно определить по формуле: cv = R/(k – 1), где R – газовая постоянная
Теплоемкость газа в изохорном процессе можно определить по формуле: cv = R/(k – 1), где k – показатель адиабаты
Теплоемкость газа в процессе рассчитывается по формуле:  –, где n: показатель политропы
–, где n: показатель политропы
Теплоемкость рабочего тела в изотермном процессе равна: ∞
Термический кпд прямого цикла определяется по формуле: ηt = 1 – q 1/ q 2, где: q 1 – подведенная теплота
Термический кпд прямого цикла определяется по формуле: ηt = 1 – q 1/ q 2, где: q 2 – отведенная теплота
Термический кпд теоретического цикла ДВС с изобарным подводом теплоты увеличивается при увеличении: степени сжатия
Термический кпд теоретического цикла ДВС с изобарным подводом теплоты уменьшается при увеличении: степени предварительного расширения
Термический кпд теоретического цикла ДВС с изохорным подводом теплоты рассчитывается по формуле: 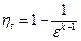 , где: ε – степень
, где: ε – степень
Термический кпд теоретического цикла ДВС с изохорным подводом теплоты увеличивается при увеличении: степени сжатия
Термический кпд теоретического цикла ДВС с изохорным подводом теплоты увеличивается при увеличении: показателя адиабаты
Термический кпд цикла ГТУ с изобарным подводом теплоты рассчитывается по формуле: 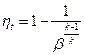 , где: β – степень увеличения давления
, где: β – степень увеличения давления
Термический кпд цикла Карно зависит от: температуры приемника теплоты,температуры источника теплоты
Термическими параметрами состояния являются абсолютная температура,удельный объем
Термическое уравнение состояния: F (p, v, T) = 0
Термодинамическая система, контрольная поверхность которой непроницаема для потока вещества закрытая
Термодинамическая система, контрольная поверхность которой непроницаема для потоков вещества или энергии изолированная
Термодинамическая система, контрольная поверхность которой проницаема для потока вещества открытая
Термодинамический процесс (последовательность процессов), совершив который термодинамическая система возвращается в исходное состояние – цикл
Точка К на рисунке – критическая точка
Точка О на рисунке – тройная точка
Точка состояния, параметры которой допускают одновременное существование твердой, жидкой и газовой фазы – тройная
Точка, в которой теплота парообразования обращается в нуль: критическая
Удельная работа, затрачиваемая на привод компрессора, определяется по формуле: l=h2 – h2, если процесс сжатия: адиабатный
Удельная теплоемкость может быть массовая, молярная и объемная
Удельная теплоемкость может быть массовая, объемная и: молярная
Удельный объем влажного пара можно определить из соотношения: vx = v/ + x(v// – v/) где: x степень сухости
Универсальная газовая постоянная – это работа, которую совершит при увеличении температуры на 1К в изобарном процессе 1 кмоль газа
Универсальная газовая постоянная численно равна 8314 Дж/кмоль К
Уравнение первого закона термодинамики для закрытой термодинамической системы записывается в виде: ∆U = Q – L, где Q – теплота
Уравнение первого закона термодинамики для закрытой термодинамической системы записывается в виде: ∆U = Q – L, где L – работа
Уравнение первого закона термодинамики для закрытой термодинамической системы записывается в виде: ∆U = Q – L, где U – внутренняя энергия
Уравнение первого закона термодинамики для проточной системы записывается в виде: ∆ h = q – l т – ∆(w 2/2) – ∆(gy), где: l т – техническая работа
Уравнение первого закона термодинамики для проточной системы записывается в виде: ∆ h = q – l т – ∆(w 2/2) – ∆(gy), где: ∆(gy) – изменение удельной потенциальной энергии
Уравнение первого закона термодинамики для проточной системы записывается в виде: ∆ h = q – l т – ∆(w 2/2) – ∆(gy), где: ∆(w 2/2) – изменение удельной кинетической энергии
Уравнение состояния в идеально-газовом состоянии – pv = RT, где R газовая постоянная
Уравнение состояния в идеально-газовом состоянии – pv = RT, где: р абсолютное давление
Уравнение состояния в идеально-газовом состоянии – pv = RT, где: v удельный объем
Уравнение термодинамического процесса: pvk = const, где k: показатель адиабаты
Уравнение термодинамического процесса: pvn = const, где n: показатель политропы
Устройство, в котором обратный цикл используется для искусственного охлаждения – холодильная машина
Устройство, применяемое для отопления зданий с использованием теплоты окружающей среды: тепловой насос
Фазовый переход вещества из газообразного в жидкое состояние конденсация
Фазовый переход вещества из твердого в газообразное состояние – сублимация
Физическая величина, используемая для характеристики состояния термодинамической системы параметр состояния
Химическая реакция, сопровождающаяся выделением теплоты: экзотермическая
Химическая реакция, сопровождающаяся поглощением теплоты: эндотермическая
Холодильный коэффициент обратного цикла Карно определяется по формуле: εх = Тхк/(То – Тхк), где То – температура окружающей среды
Цикл теплового двигателя, в котором рабочее тело не сменяемо: Стирлинга
Цикл теплового двигателя, состоящий из двух изотерм и двух изохор: Стирлинга
Цикл, в котором теплота переносится от холодного тела к горячему: обратный
Цикл, в котором теплота подводиться в изобарном процессе: Дизеля
Цикл, в котором теплота превращается в работу: прямой
Цикл, состоящий из двух изотерм и двух адиабат: Карно
Цикл, термический кпд которого больше, чем у любого другого цикла, совершающегося в том же интервале температур: Карно
Цикл, термический кпд которого не зависит от свойств рабочего тела: Карно
Часть полного запаса энергии термодинамической системы, не связанная с положением ее в поле внешних сил или движением: внутренняя энергия
Число независимых параметров однозначно определяющих состояние идеального газа 2
Число степеней свободы гетерогенной системы, находящейся в равновесии определяется по формуле: С = 2 – Ф + n, где Ф – число фаз
Число степеней свободы гетерогенной системы, находящейся в равновесии определяется по формуле: С = 2 – Ф + n, где n – число компонентов
Число степеней свободы равновесной системы, образованной из двух фаз чистого вещества: 1
Число степеней свободы равновесной системы, образованной из трех фаз чистого вещества: 0
Число степеней свободы равновесной системы, состоящей из чистого однофазного вещества: 2
Элементы паросиловой установки, работающей по циклу Ренкина: конденсатор,насос
Элементы, входящие в состав ГТУ: камера сгорания,компрессор
Элементы, входящие в состав двигателя Стирлинга: регенератор,вытеснитель
Эффективность обратного (холодильного) цикла характеризует: холодильный коэффициент
Эффективность превращения теплоты в работу в прямом цикле характеризует: термический кпд
Эффективность цикла теплового насоса характеризует: отопительный кпд
В термодинамической системе по различным причинам может происходить изменение внутренней энергии. Согласно закону сохранения энергии энергия не создаётся и не уничтожается, но одна форма энергии может переходить в другую. Частным случаем закона сохранения энергии является первый закон термодинамики, который гласит: поглощённая системой теплота q расходуется на изменение внутренней энергии DU системы и на совершение ею работы против сил внешнего давления
–Q = q = DU + A. (1)
В уравнении 1 DU, q и А имеют одну и ту же единицу измерения – килоджоуль.
Теплота q – это форма передачи энергии за счёт хаотического столкновения частиц двух соприкасающихся систем. Теплота не является функцией состояния, она зависит от пути протекания реакции.
Работа А – это форма передачи энергии при организованном, упорядоченном перемещении частиц под действием сил давления, поверхностного натяжения, электрических, магнитных и др. Работа так же, как теплота, не является функцией состояния и зависит от пути протекания процесса. Работа против сил, действующих на систему при Р = const, выражается
А = Р(V2 – V1) = PDV, (2)
где DV = V2 – V1 – изменение объёма системы.
В том случае, когда работа направлена на преодоление внешнего давления, изменение объёма DV>0, так как V2 > V1 (расширение системы), и работа будет величиной положительной А>0.
При обратном процессе (сжатие системы) работа затрачивается извне DV<0, так как V2 < V1, поэтому работа является отрицательной величиной А<0.
Для изобарно-изотермического процесса, применяя первый закон термодинамики (уравнение 1), получаем:
q = DU + PDV или q = U2 – U1 + P(V2 – V1),
перегруппируем члены уравнения следующим образом
q = U2 – U1 + PV2 – РV1 = (U2 + PV2) – (U1 + РV1). (3)
Введём новую термодинамическую функцию – энтальпию. Энтальпия Н – это сумма внутренней энергии системы и энергии тел, поддерживающих постоянное давление в системе:
Н = U + PV. (4)
Внутренняя энергия U, давление Р и объём V – функции состояния. Следовательно, энтальпия – тоже функция состояния.
Заменяя в уравнении 3 U2 + PV2 энтальпией продуктов реакции Н2 и
U1 + PV1 энтальпией исходных веществ реакции Н1, получаем при Р = const:
q = H2 – H1 = DH. (5)
Для процессов, протекающих при V = const, DV = 0, поэтому А = 0 и уравнение 1 можно записать
q = DU, (6)
где DU = U2 – U1 – изменение внутренней энергии.
Таким образом, теплота процесса при постоянном давлении (Р = const) характеризуется изменением энтальпии (уравнение 5), а при постоянном объёме
(V = const) – изменением внутренней энергии (уравнение 6).
Из уравнений 5 и 6 следует, что для изохорного и изобарного процессов теплота процесса приобретает свойства функции состояния. В этом случае q = –QP и q = –QV называют тепловыми эффектами.
Тепловой эффект – это количество теплоты, выделенной или поглощённой в результате данного физико-химического процесса, при условии: 1)Р –, V – и
Т – const; 2) единственным видом работы, совершаемой системой, является работа, связанная с действием внешнего давления на систему.
Химические реакции приводят к превращению одних веществ в другие. Это связано с перестройкой электронных структур атомов и молекул, в результате чего внутренняя энергия веществ и всей системы в целом может измениться, поэтому химические реакции, а также процессы, в которых происходит изменение фазового состояния вещества, протекают с выделением или поглощением тепла.
Экзотермические реакции протекают с выделением теплоты. Для таких реакций QP и QV > 0; DН и DU < 0, т.е. если в ходе реакции тепло выделяется, то энтальпия и внутренняя энергия системы уменьшаются
Эндотермические реакции протекают с поглощением теплоты. Для них QP и QV < 0; DН и DU > 0, т.е. если в ходе реакции тепло поглощается, то энтальпия и внутренняя энергия системы увеличиваются. Таким образом,
QP = – DН, QV = – DU. (7)
|
|
Дата добавления: 2015-05-10; Просмотров: 6738; Нарушение авторских прав?; Мы поможем в написании вашей работы!