
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика определения
|
|
|
|
Лабораторная работа №3
СТАНДАРТИЗАЦИЯ ВТОРИЧНОГО СТАНДАРТА ПЕРМАНГАНАТА КАЛИЯ KMnO4
ПО ПЕРВИЧНОМУ СТАНДАРТУ ОКСАЛАТУ АММОНИЯ (NH4)2C2O4·H2O.
Метод титриметрического анализа:
редоксиметрия, метод перманганатометрии
Цель работы: Познакомиться с методикой определения точной концентрации вторичного стандартаKMnO4.
Задача:
1.Установить точную концентрацию вторичного стандарта по прилагающейся методике.
2. По результатам титрованиярассчитать точную концентрацию вторичного стандартаKMnO4,выраженную через Т(титр) и Сн (нормальную концентрацию); К0,05н(поправочный коэффициент к нормальности) и сложный титр Т KMnO4/(NH4)2C2O4·H2O
Чтобы определить точную концентрацию вторичного стандарта KMnO4 необходимо провести титрование. Титрование - это медленное прибавление вторичного стандарта KMnO4, из бюретки, к подкисленному раствору (аликвоте) (NH4)2C2O4·H2O в конической колбе до наступления момента эквивалентности.
Требования техники безопасности при выполнении работы:
- Необходимо соблюдать свое рабочее место в чистоте и порядке.
- При выполнении работы рационально использовать рабочее время.
- Необходимо соблюдать правила работы со стеклянной посудой.
- Аликвоту раствора следует отбирать нагнетателем или грушей.
- Необходимо соблюдать правила техники безопасности при работе с электрооборудованием.
- Принимать пищу в лаборатории запрещается
- По окончании работы необходимо убрать за собой рабочее место
1.Химическая сущность определения:
2KMnO4 + 5(NH4)2C2O4 + 8 H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O + 5(NH4)2SO4
2| MnO4- + 8H+ + 5е- → Mn2+ + 4H2O
5| C2O42- - 2e- → 2CO2
———————————————————————
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
Мэ (KMnO4) = М/5 = 31,61 г/моль
Мэ ((NH4)2C2O4·H2O) = M/2 = 71.06 г/моль
|
|
|
Химические реактивы:
1. оксалат натрия, (NH4)2C2O4·H2O,первичный стандарт, раствор точной концентрации;
2.перманганат калия, KMnO4, вторичный стандарт, раствор приблизительной концентрации
3.серная кислота, H2SO4, 2н раствор
4.вода дистиллированная
Посуда и оборудование:
1.коническая колба, емкостью 250-300мл
2.мерная колба, емкостью 100,00мл(200,00мл и 250,00мл);
3.мерный цилиндр
4.химическая воронка;
5.часовое стекло;
5.промывалка.
6.электрическая плитка
Бюретку ополоснуть дистиллированной водой, затем раствором KMnO4. Заполнить бюретку раствором KMnO4 до 0 (по правилам работы с бюреткой). Коническую колбу ополоснуть дистиллированной водой. Пипетку ополоснуть раствором оксалата аммония (NH4)2C2O4·H2O.
Пипеткой отобрать аликвоту раствора (NH4)2C2O4·H2O (10,00 мл) и перенести в коническую колбу (носик не выдувать!). Прилить к содержимому в конической колбе 10мл 2н раствора H2SO4, и нагреть смесь до 80 ºС (не кипятить!). Горячий раствор оттитровать раствором KMnO4 до устойчивой слабо – розовой окраски, не исчезающей в течение 30сек. Титрование повторить не менее 3-х раз, результаты титрования записать в таблицу. Вычислить средний объем KMnO4, израсходованный на титрование аликвоты раствора (NH4)2C2O4·H2O.
По результатам титрования вычислить точную концентрацию раствора KMnO4,
3. Пример вычисления точной концентрации раствора KMnO4 по результатам титрования, выраженной через Сн(KMnO4), Т(KMnO4), К0,05Н , Т(KMnO4/(NH4)2C2O4·H2O)
Задача: На титрование 10,00 мл раствора (NH4)2C2O4·H2O израсходовано 9,80 мл раствора KMnO4 (средний объем). Вычислить Сн (KMnO4), Т(KMnO4), К0,05Н , Т(KMnO4/(NH4)2C2O4·H2O), если
Сн (NH4)2C2O4·H2O) = 0,05001 моль/л.
| Дано: Сн (NH4)2C2O4*H2O= = 0,05001 моль/л V (NH4)2C2O4*H2O = 10,00 мл V(KMnO4) = 9,80 мл Мэ (KMnO4) = М/5 = 31,61 г/моль Мэ (NH4)2C2O4*H2O = М/2 = 71,06 г/моль | 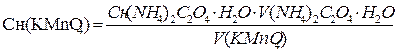
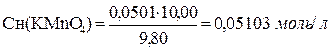



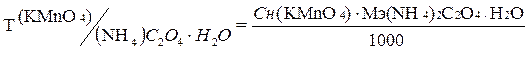 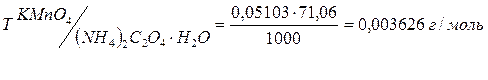
|
| Сн (KMnO4)-? К0,05н,-? Т(KMnO4)-? Т(KMnO4)/ (NH4)2C2O4*H2O-? |
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 933; Нарушение авторских прав?; Мы поможем в написании вашей работы!