
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические основы
|
|
|
|
Лабораторная работа № 8
Определение содержания уксусной кислоты методом потенциометрического титрования
Цели: 1. Приобрести практический опыт потенциометрического титрования.
2. Построить графическую зависимость электродного потенциала от объема титранта.
3. Определить по графику конечную точку титрования и рассчитать содержание уксусной кислоты в растворе.
Косвенный потенциометрический методоснован на резком скачкообразном изменении электродного потенциала вблизи точки эквивалентности. При потенциометричеcком титрованиирегистрируют изменение потенциала в процессе химической реакции между определяемым веществом и титрантом. В косвенном потенциометрическом методе строят графическую зависимость электродного потенциала от объема титранта, по графику находят конечную точку титрования и рассчитывают содержание вещества в анализируемом растворе.
В методе потенциометрического титрования используют реакции основных типов: кислотно-основные, окислительно-восстановительные, процессы осаждения, а также комплексообразования.
Индикаторный электрод выбирают в зависимости от типа химической реакции и природы потенциалопределяющих ионов.
В кислотно-основном титровании в качестве индикаторного используют стеклянный электрод. При титровании по методу окисления-восстановления в качестве индикаторных применяют платиновые электроды. При титровании с образованием малорастворимых и комплексных соединений в качестве индикаторных используют металлические электроды из серебра и ртути.
Потенциальное титрование широко используют в технологическом контроле пищевых производств для определения общей (титруемой) кислотности пищевых продуктов (хлеба, молока, молочных продуктов, напитков и др.), а также количественного определения кислот, щелочей, солей.
|
|
|
В основе кислотно-основного титрования лежит реакция:
СНзСООН + NaOH = CH3COONa + H2О
Установка для потенциометрического титрования состоит из электрохимической ячейки (стакан с исследуемым раствором, в который погружены индикаторный электрод и электрод сравнения) и бюретки, заполненной титрантом (рис. 1).
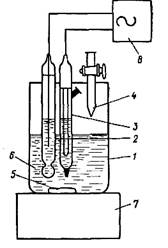
Рис. 1. Установка для потенциометрического титрования
1 — стакан для титрования; 2 — индикаторный электрод; 3 — электрод сравнения; 4 — бюретка; 5 — магнит; 6 — исследуемый раствор;
7 — магнитная мешалка; 8 — рН-метр
В стакан с анализируемым раствором порциями приливают из бюретки титрант и фиксируют значение рН (или электродного потенциала Е). Возможные графические зависимости для определения конечной точки титрования представлены на рис. 2.

Рис. 2 Виды потенциометрических кривых
а – интегральная кривая; б – дифференциальная кривая;
в – кривая по второй производной
Аппаратура и реактивы:
· рН-метр любой марки;
· стеклянный ионоселективный электрод;
· насыщенный хлорсеребряный электрод сравнения;
· электромагнитная мешалка;
· стаканчики вместимостью 100 см3 и 50 см3;
· бюреткавместимостью 25 см3; пипетка вместимостью 10 см3;
· мерная колба вместимостью 100 см3;
· стандарт-титры для рН-метра с рН = 4,01; рН = 6,86; рН = 9,18;
· дистиллированная вода;
· стандартный раствор НС1,0,1 моль/дм3 (готовят из фиксанала);
· раствор NaOH,0,1 моль/дм3;
· исследуемый раствор уксусной кислоты.
Порядок выполнения работы
1) Подготовка к работе электродов и настройка прибора по буферным растворам. Стеклянный электрод выдерживают в слабом растворе кислоты (0,1 М р-р НС1), хлорсеребряный электрод заполняют 1М раствором KCl. Настройку прибора проводят по буферным растворам с рН = 4,01, рН = 6,86, рН = 9,18.
|
|
|
2) Стандартизация раствора гидроксида натрия. Концентрацию раствора гидроксида натрия предварительно устанавливают по 0,1 М раствору НС1, приготовленному из фиксанала, методом потенциометрического титрования.
| Сначала проводят ориентировочное титрование. Для этого в стакан для титрования пипеткой вводят 10 см3 р-ра NaOH, добавляют столько дистиллированной воды, чтобы покрыть поверхность электродов. Бюретку заполняют 0,1 М р-ром НС1 с точной концентрацией и прибавляют титрант по 1,0 см3, снимая показания прибора (рН). Находят объем титранта, приблизительно соответствующий конечной точке титрования. Результаты измерений заносят в таблицу 1. Таблица 1 - Результаты ориентировочного титрования раствора NaOH | |
| Объем 0,1 М р-ра НС1 (V), см3 | рН |
Затем приступают к точному титрованию в области скачка Е (рН), для чего в чистый стакан для титрования вносят новую аликвоту 10 см3 испытуемого раствора NaOH, бюретку с 0,1 М р-ром НС1 доливают до нулевого значения и прибавляют титрант по 0,2 см3 , записывая значения рН. Результаты измерений заносят в таблицу 2.
| Таблица 2 - Результаты точного титрования раствора NaOH | |
| Объем 0,1 М р-ра НС1 (V), см3 | рН |
Строят графическую зависимость рН от объема титранта (0,1 М р-ра НС1) и находят по графику объем титранта, соответствующий КТТ (VHCl). По оси ординат откладывают значения рН, по оси абсцисс – значение объема титранта. По объему р-ра НС1, затраченного на титрование раствора щелочи, вычисляют концентрацию щелочипо формуле (1):
 (1)
(1)
3)Определение содержания уксусной кислоты. Полученный контрольный раствор в мерной колбе вместимостью 100 см3 разбавляют дистиллированной водой до метки. Для анализа отбирают пипеткой аликвотную часть (10 см3), переносят в стакан для титрования. В стакане исследуемый раствор разбавляют небольшим количеством дистиллированной воды так, чтобы электроды были погружены в раствор на 1,5 - 2 см. Бюретку заполняют стандартизированным р-ром NaOH с установленной концентрацией.
Сначала проводят ориентировочное титрование, прибавляя из бюретки по 1,0 см3 р-ра щелочи, снимая показания прибора (рН). Результаты заносят в таблицу 3.
| Таблица 3 - Результаты ориентировочного титрования раствора СНзСООН | |
| Объем р-ра NaOH (V), см3 | рН |
|
|
|
Затем приступают к точному титрованию в области скачка Е (рН), для этого в чистый стакан для титрования вносят новую аликвоту 10 см3 исследуемого раствора СНзСООН, бюретку с р-ром NaOH доливают до нулевого значения и прибавляют титрант по 0,2 см3 , записывая значения рН. Результаты измерений заносят в таблицу 4.
| Таблица 4 - Результаты точного титрования раствора СНзСООН | |
| Объем р-ра NaOH (V), см3 | рН |
По результатам титрования строят график в координатах: рН - VNaOH, cм3. По оси ординат откладывают значения рН, по оси абсцисс – значение объема NaOH и определяют конечную точку титрования.
Граммовое содержание уксусной кислоты в исследуемом растворе вычисляют по формуле (2):
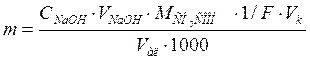 (2)
(2)
где m – содержание уксусной кислоты в растворе, г;
CNaOH - молярная концентрация раствора NaOH, моль/дм3;
VNaOH - объем раствора NaOH, израсходованного на титрование, (найденный по графику), см3;
V ал - объем аликвоты кислоты, см3;
Vк - вместимость мерной колбы, см3;
MCH3COOH - молярная масса уксусной кислоты, г/моль;
F – фактор эквивалентности уксусной кислоты (для СН3СООН F =1);
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 2467; Нарушение авторских прав?; Мы поможем в написании вашей работы!