
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ПЛЮМБУМ 2 страница
|
|
|
|
Загальна характеристика неметалів
Елементи з неметалевими властивостями знаходяться в IIIA-VIIA - групах Періодичної системи.
Зазвичай серед неметалів розглядають також водень Н, хоча це не зовсім точно, оскільки водню притаманні як неметалеві, так і металеві хімічні властивості.
Загальна електронна формула атомів неметалів ns2np1-5, цьому відповідає велика різноманітність ступенів окислення неметалів у з'єднаннях. Характерною особливістю неметалів є більший (в порівнянні з металами) число електронів на зовнішньому енергетичному рівні їх атомів. Це визначає їх велику здатність до приєднання додаткових електронів і прояву високою окисної активності. Ось чому значення електронегативності у них великі. Звідси різноманіття в хімічних властивостях і способах отримання неметалів.
Інша характерна особливість неметалів - прагнення утворювати ковалентні зв'язки з атомами інших неметалів і амфотерних елементів. Тому і прості речовини і сполуки неметалів мають ковалентное будова.
У вільному вигляді зустрічаються газоподібні речовини - F2, Cl2, O2, N2 і Н2, тверді - I2, At, S, Te, P, As, C, Si і В, при кімнатній температурі відомий один рідкий неметал - бром Br2.
Нерідко для неметалів спостерігається алотропія, наприклад у кисню (О2 і О3) і вуглецю (графіт, алмаз, карбін, фулерен).
У природі зустрічаються самородні неметали - N2 і O2 (в повітрі), сірка (в земній корі), але частіше неметали в природі знаходяться в хімічно зв'язаному вигляді. В першу чергу це вода і розчинені в ній солі, потім - мінерали і гірські породи (наприклад, різні силікати, алюмосилікати, фосфати, борати, сульфати і карбонати).
За поширеністю в земній корі неметали займають самі різні місця: від трьох найпоширеніших елементів (O, Si, H) до досить рідких (As, Se, I, Te).
|
|
|
Карбо́н (С) або вугле́ць — хімічний елемент з атомним номером 6. Назва Карбон рекомандована IUPAC, вуглець — традиційна назва. Карбон належить до групи 14 періодичної системи за сучасною класифікацією або до основної підгрупи IV групи за старою класифікацією. Простої речовини під назвою вуглець не існує, різні алотропіні видозміни Карбону мають свої власні назви.
Карбон є одним із поширених елементів земної кори, складаючи близько 0,1% її маси. Сполуки вуглецю є основою всіх живих організмів.
Алотропні видозміни вуглецю.
Елементарний вуглець утворює три алотропні видозміни: алмаз, графіт і карбін.
Алмаз - безбарвна, прозора кристалічна речовина, що надзвичайно сильно переломлює промені світла. Атоми вуглецю в алмазі знаходяться в стані sp3-гібридизації. У збудженому стані відбувається розпарювання валентних електронів в атомах вуглецю та освіта чотирьох не спарених електронів.
Кожен атом вуглецю в алмазі оточений чотирма іншими, розташованими від нього в напрямку від центра в тетраедрів до вершин. Відстань між атомами в тетраедрах дорівнює 0, 154 нм. Міцність усіх зв'язків однакова. Таким чином, атоми в алмазі «упаковані» дуже щільно. При 20оС щільність алмаза складає 3,1515 г/см3. Цим пояснюється його виняткова твердість. Алмаз погано проводить електричний струм. Основна маса утворених алмазів - невеликі кристали й алмазний пил.
Алмази при нагріванні без доступу повітря вище 1000оС перетворюється в графіт. При 1750оС перетворення алмазу в графіт відбувається швидко.
Графіт - сіро-чорна кристалічна речовина з металевим блиском, жирна на дотик, по твердості поступається навіть паперу.
Атоми вуглецю в кристалах графіту знаходяться в стані sp2 - гібридизації: кожний з них утворює трьох ковалентні ơ-зв'язкуз сусідніми атомами. Кути між напрямками зв'язків дорівнює 120о. У результаті утвориться сітка, що складається з правильних шестикутників. Відстань між сусідніми ядрами атомів вуглецю всередині шару складає 0,142 нм.
|
|
|
Графіт має низьку механічну міцність і легко розщеплюється на лусочки, які самі по собі дуже міцні. Зв'язок між шарами атомів вуглецю в графіті частково має металевий характер. Цим пояснюється той факт, що графіт добре проводить електричний струм, але все ж не так, як метал.
При нагріванні без доступу повітря графіт не зазнає ніякої зміни до 3700оС. При зазначеній температурі він виганяється, не плавлячись. Графіт термодінамічен, стійкий у широкому інтервалі температур і тисків. Щільність складає 2,256 г/см3.
Адсорбція (лат. ad - на, при; sorbeo - поглинаю) - це, в широкому сенсі, процес зміни концентрації біля поверхні розділу двох фаз, а в більш вузькому і вживаною - це підвищення концентрації однієї речовини (газ, рідина) біля поверхні іншого речовини (рідина, тверде тіло).
2KMnO4+16HCI=2KCI+2MnCI2+5CI2+8H2O
Mn+7-5e=Mn+2 5 10 2
2CI-+2e=CI20 2 5
№ 22
Властивості кислот, основ і солей з точки зору теорії електролітичної дисоціації
Розглянемо у світлі теорії електролітичної дисоціації властивості речовин, які у водних розчинах виявляють властивості електролітів.
Кислоти. Для кислот характерні наступні загальні властивості:
здатність взаємодіяти з основами з утворенням солей;
здатність взаємодіяти з деякими металами з виділенням водню;
здатність змінювати кольори індикаторів, зокрема, викликати червоне забарвлення лакмусу;
кислий смак.
При дисоціації будь-якої кислоти утворюються іони водню. Тому всі властивості, які є загальними для водних розчинів кислот, ми повинні пояснити присутністю гідратованих іонів водню. Це вони викликають червоний колір лакмусу, повідомляють кислот кислий смак і т.д. З усуненням іонів водню, наприклад при нейтралізації, зникають і кислотні властивості. Тому теорія електролітичної дисоціації визначає кислоти як електроліти, диссоциирующие в розчинах з утворенням іонів водню.
У сильних кислот, диссоциирующих без остачі, властивості кислот проявляються в більшій мірі, у слабких - меншою. Чим краще кислота дисоціює, тобто чим більше її константа дисоціації, тим вона сильніша.
|
|
|
Величини констант дисоціації кислот змінюються в дуже широких межах. Зокрема, константа дисоціації ціановодорода багато менше, ніж оцтової кислоти. І хоча обидві ці кислоти - слабкі, все ж оцтова кислота значно сильніше ціановодорода. Величини першої та другої констант дисоціації сірчаної кислоти показують, що стосовно першого ступеня дисоціації H 2 SO 4 - сильна кислота, а щодо другої - слабка. Кислоти, константи дисоціації яких лежать в інтервалі 10 -4 - 10 -2, іноді називають кислотами середньої сили. До них, зокрема, відносяться ортофосфорна і сірчиста кислоти (щодо дисоціації за першого ступеня).
Підстави. Водні розчини підстав володіють такими загальними властивостями:
здатністю взаємодіяти з кислотами з утворенням солей;
здатністю змінювати кольори індикаторів інакше, ніж їх змінюють кислоти (наприклад, вони викликають синє забарвлення лакмусу);
Своєрідним "мильною" смаком.
Оскільки спільним для всіх розчинів підстав є присутність у них гідроксид-іонів, то ясно, що носієм основних властивостей є гідроксид-іон. Тому з точки зору теорії електролітичної дисоціації підстави - це електроліти, диссоциирующие в розчинах з відщепленням гідроксид-іонів.
Сила підстав, як і сила кислот, залежить від величини константи дисоціації. Чим більше константа дисоціації даної підстави, тим воно сильніше.
Існують гідроксиди, здатні вступати у взаємодію і утворювати солі не тільки з кислотами, але і з основами. До таких гідроксиду належить гідроксид цинку. При взаємодії його, наприклад, з соляною кислотою виходить хлорид цинку:
Zn (OH) 2 + 2 НС l = ZnС l 2 + 2 Н 2 О
а при взаємодії з гідроксидом натрію - цінкат натрію:
Zn (OH) 2 + 2 NaOH = Na 2 ZnО 2 + 2 Н 2 О
Гідроксиди, які володіють цією властивістю, називаються амфотерними гідроксидами або амфотерними електролітами. До таких гідроксиду, крім гідроксиду цинку, відносяться гідроксиди алюмінію, хрому і деякі інші.
Явище амфотерности пояснюється тим, що в молекулах амфотерних електролітів міцність зв'язку між металом і киснем незначно відрізняється від міцності зв'язку між киснем і воднем. Дисоціація таких молекул можлива, отже, по місцях обох цих зв'язків. Якщо позначити амфотерний електроліт формулою ROH, то його дисоціацію можна виразити схемою
|
|
|
Н + + RO - ↔ ROH ↔ R + + OH -
Таким чином, у розчині амфотерного електроліту існує складна рівновага, в якому беруть участь продукти дисоціації як за типом кислоти, так і за типом підстави.
Явище амфотерности спостерігається також серед деяких органічних сполук. Важливу роль воно відіграє у біологічної хімії; наприклад, білки - амфотерні електроліти.
Солі. Солі можна визначити як електроліти, які при розчиненні у воді дисоціюють, отщепляя позитивні іони, відмінні від іонів водню, і негативні іони, відмінні від гідроксид-іонів. Таких іонів, які були б спільними для водних розчинів усіх солей, немає, тому солі і не володіють загальними властивостями. Як правило, солі добре дисоціюють, і тим краще, чим менше заряди іонів, які утворюють сіль.
При розчиненні кислих солей у розчині утворюються катіони металу, складні аніони кислотного залишку, а також іони, що є продуктами дисоціації цього складного кислотного залишку, у тому числі іони Н +. Наприклад, при розчиненні гідрокарбонату натрію дисоціація протікає відповідно до наступних рівнянь:
NaHCO 3 = Na + + HCO 3 -
HCO 3 - = Н + + CO 3 2 -
При дисоціації основних солей утворюються аніони кислоти і складні катіони, що складаються з металу і гидроксогрупп. Ці складні катіони також здатні до дисоціації. Тому в розчині основної солі присутні іони ОН -. Наприклад, при розчиненні хлориду гідроксомагнія дисоціації протікає відповідно до рівнянь:
MgOHCl = MgOH + + З l -
MgOH + = Mg 2 + + ОН -
Таким чином, теорія електролітичної дисоціації пояснює загальні властивості кислот присутністю в їх розчинах іонів водню, а загальні властивості підстав - присутністю в їх розчинах гідроксид-іонів. Це пояснення не є, однак, загальним. Відомі хімічні реакції, що протікають за участю кислот і підстав, до яких теорія електролітичної дисоціації непридатна: Зокрема, кислоти і підстави можуть реагувати один з одним, не будучи дисоційований на іони. Так, безводний хлороводень, що складається тільки з молекул, легко реагує з безводними підставами. Крім того, відомі речовини, які не мають у своєму складі гидроксогрупп, але проявляють властивості основ. Наприклад, аміак взаємодіє з кислотами і утворює солі (солі амонію), хоча в його складі немає груп ОН. Так, з хлороводородом він утворює типову сіль - хлорид амонію:
NH 3 + HC1 = NH 4 C1
Вивчення подібного роду реакцій, а також реакцій, що протікають у неводних середовищах, призвело до створення більш загальних уявлень про кислотах і підставах. До найважливіших з сучасних теорій кислот і підстав належить протонна теорія, висунута в 1923 р.
Згідно протонної теорії, кислотою є донор протона, тобто частка (молекула або іон), яка здатна віддавати іон водню - протон, а підставою - акцептор протона, тобто частка (молекула або іон), здатна приєднувати протон. Співвідношення між кислотою і підставою визначається схемою:
Підстава + Протон ↔ Кислота
Пов'язані цим співвідношенням підставу і кислота називаються сполученими. Наприклад, іон HSO 4 - є підставою, сполученим кислоті H 2 SO 4.
Реакцію між кислотою і підставою протонна теорія являє схемою:
(Кислота) 1 + (Підстава) 2 = (Кислота) 2 + (Підстава) 1
Наприклад, в реакції
HC1 + NH 3 = NH 3 + + З l -
іон З l - підстава, поєднане кислоті НС1, а іон NH 3 + - кислота, сполучена підставі NH 3.
Істотним у протонної теорії є те положення, що речовина проявляє себе як кислота або як підставу в залежності від того, з яким іншим речовиною воно вступає в реакцію. Найважливішим чинником при цьому є енергія зв'язку речовини з протоном. Так, у низці NH 3 - Н 2 О - HF ця енергія максимальна для NH 3 і мінімальна для HF. Тому в суміші з NH 3 вода функціонує як кислота, а в суміші з HF - як підстава:
NH 3 + Н 2 О = NH 4 + + ОН -
HF + Н 2 О = F - + Н 3 О +
Осно́вні оксиди
Основні оксиди - це оксиди, яким відповідають основи. Основними оксидами є, наприклад, Na2O, CaO, MgO, K2O. Декотрі оксиди легко взаємодіють з водою з утворенням відповідних основ:
CaO + H2O → Ca(OH)2
K2O + H2O → 2KOH.
Оксиди Fe2O3, CuO, Ag2O з водою не взаємодіють, однак вони нейтралізують кислоти і тому вважаються основними.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
CuO + H2SO4 → CuSO4 + H2O
Характерною хімічною властивісттю основних оксидів є їхня взаємодія з кислотами, при цьому, як правило, утворюються сіль і вода
FeO + 2HCl → FeCl2 + H2O
При взаємодії з кислотними і амфотерними оксидами утворюють солі, а між собою не взаємодіють. Наприклад:
СаО + СО2 = СаСО3
Na2O + ZnO = Na2ZnO2
Основні оксиди утворюються тільки металами з низькою валентністю (не вище 3+). Більшість основних оксидів з водою безпосередньо не взаємодіють, за винятком оксидів лужних і лужноземельних металів, які реагують з водою. Усім основним оксидам відповідають основи, тобто гідроксиди, які проявляють властивості основ.
Кислотні оксиди
До кислотних оксидів відносять такі оксиди, які взаємодіють з основними та амфотерними оксидами, а також з їх гідроксидами з утворенням солей. Наприклад:
P2О5 + 3СаО → Са3(РО4)2
SO3 + ZnO → ZnSO4
CO2 + 2NaOH → Na2СО3 + Н2О
Кислотні оксиди називають звичайно ангідридами (зневодненими кислотами), вказуючи цим, що їх можна одержати з кислот, віднімаючи від них елементи води. Кислотні оксиди утворюються неметалами та деякими металами, які проявляють змінну валентність. Валентність металів у кислотних оксидах буває, від 4+ до 7+. Наприклад CrO3 — хроматний ангідрид (валентність хрому 6+), Mn2O7 — ангідрид марганцю (валентність марганцю 7+) і т. д.
Деякі кислотні оксиди взаємодіють з водою, утворюючи відповідні гідроксиди, тобто кислоти. Є кислотні оксиди, які не взаємодіють з водою. Наприклад, SiO2 практично не розчинний у воді, однак він нейтралізує основи, тому є кислотним оксидом
2NaOH + SiO2 →сплавлення Na2SiO3 + H2O
Гідроксиди, тобто кислоти, тих кислотних оксидів, що безпосередньо з водою не взаємодіють, одержують посереднім шляхом.
Амфотерні оксиди
Амфотерними називають такі оксиди, які взаємодіють як з кислотами, так і з основами, утворюючи сіль і воду. При взаємодії з кислотами вони поводять себе як основні оксиди, а при взаємодії з основами — як кислотні.
ZnO + H2SO4 → ZnSO4 + H2О
ZnO + 2NaOH → Na2ZnO2 + H2О
З водою амфотерні оксиди не взаємодіють. Амфотерні оксиди утворюються тільки металами з валентністю від 2+ до 4+. До амфотерних оксидів належать ZnO, SnO, PbO, Al2О3, SnO2, PbO2 і ін.
Отже, неметали утворюють тільки кислотні оксиди, а метали можуть утворювати основні, амфотерні і кислотні. Причому для металів із змінною валентністю існує така залежність: при низькому валентному стані металу (не вище 3+) він утворює основний оксид, при високому валентному стані (від 4+ до 7+) він утворює кислотний оксид, а при проміжному (звичайно від 2+ до 4+) він утворює амфотерний оксид. Основні, кислотні і амфотерні оксиди називають ще солетвірними, бо вони при взаємодії з кислотами або основами утворюють солі.
Перша допомога при отруєнні полягає у винесенні потерпілого на свіже повітря, проведенні штучного дихання.
Білет № 25
1)Охарактеризуйте окисно-відновні реакції,їх типи.Визначення коефіцієнтів у рівняннях окисно-відновних реакцій методом електронного балансу.
О́кисно-відно́вна реа́кція — хімічна реакція, яка відбувається зі зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником та атомом-відновником.
Типи:
- міжмолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в різних молекулах, наприклад:
-внутрішньомолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в одній і тій ж самій молекулі, наприклад:
-репропорціонування (компропорціонування)
-диспропорціонування (самоокиснення-самовідновлення) - реакції, в яких атоми одного елементу перетворюються на речовину (речовини) зі змінною ступенів окиснення, наприклад:
Окисно-відновна реакція між воднем та фтором:
Поділяється на дві напівреакції:
1) Окиснення:
2) Відновлення:
Атоми та йони, які в даній реакції приєднують електрони є окисниками, а які віддають електрони -відновниками.
Метод електронного балансу – це один з методів зрівнювання окислювально-відновних реакцій(ОВР).Полягає в тому щоб на підставі мір окислення розставити коефіцієнти в ОВР.Для правильного зрівнювання слід дотримуватися певної послідовності дій:
Знайти окисник і відновник.
Скласти для них схеми(напівреакції) переходів електронів, що відповідають цьому окислювально-відновному процесу.
Зрівняти число відданих і прийнятих електронів в напівреакціях.
Підсумувати нарізно ліві і праві частини напівреакцій.
Розставити коефіцієнти в рівнянні окислювально відновної реакції.
Приклад: Li + N2 = Li3N
Li0 + N20 = Li3+1N−3
Li0 — 1e = Li+1
Отримуємо:
6Li0 — 6e = 6Li+1
N20 + 6e = 2N−320 + 6e = 2N−3
6Li + N2 = 2Li3N
2)Проаналізуйте поширення в природі,властивості,одержання і застосування лужних металів та їх сполук.
Лужні метали - це елементи 1-ї групи періодичної таблиці хімічних елементів (по застарілої класифікації - елементи головної підгрупи I групи): літій Li, натрій Na, калій K, рубідій Rb, цезій Cs і францій Fr. При розчиненні лужних металів в воді утворюються розчинні гідроксиди, звані лугами. Лужні метали зустрічаються в природі у формі сполук, що містять однозарядні катіони. Багато мінералів містять у своєму складі метали головної підгрупи I групи.
Фізичні властивості
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі. Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються в атмосфері інертного газу або під шаром гасу)
Хімічні властивості:
- Взаємодія з водою:
- Взаємодія з киснем:
-реагують із неметалами: 2Na + S = Na2S
2K + Br2 = 2KBr
Отримання лужних металів:
-Для отримання лужних металів використовують в основному електроліз розплавів їх галогенідів, найчастіше - хлоридів, що утворюють природні мінерали:
-проводять електроліз розплавів їх гідроксидів:
-Лужний метал може бути відновлений з відповідного хлориду або броміду кальцієм, магнієм, кремнієм та ін восстановителями при нагріванні під вакуумом до 600-900 C:
Білет №26
1) Охарактеризуйте будову комплексних сполук.Типи хім..зв.в комплексних сполуках.
Комплексні сполуки – це стійкі хім.сполуки,у вузлах кристалічної гратки яких,містяться складні частинки,що містять центральний атом або йон і оточуючи його молекули або йони.
Будова КС: К3[Fe(CN)6]:зовнішня сфера,внутрішня сфера,ліганда,координаційне число,центральний атом(комплексоутворювач).В ролі комплексоутворювача виступають d – елементи.Координаційне число – це число зв’язків за допомогою яких,ліганди зв’язуються з комплексоутворювачем,воно залежить від природи комплексоутворювача і ліганд,із збільшенням ступеня окиснення центрального атома зростає і значення координаційного числа,яке переважно у 2 рази більше від валентності комплексоутворювача, і в більшості випадків має значення 2,4,6.Ліганди характеризує координаційна ємність або дентатність,що визначає кількість місць який займає ліганд у внутрішній координаційній сфері.
Природа хім.зв.в К.С.:
- Метод валентних зв’язків – пояснює утв.КС.за рахунок донорно-апцепторного зв’язку.Донором виступає атом,що входить до складу ліганда.
- Теорія кристалічного поля – пояснює властивості хім.сполук кристалічної будови,основана на тому,що між комплексоутворювачем і лігандами виникає електростатична взаємодія,як і при утворенні йонного зв’язку.
- Метод молекулярних орбіта лей,оснований на уявленні про утворення молекулярних орбіта лей,шляхом комбінації атомних орбіта лей комплексоутворювача і лігандів.
2) Проаналізуйте знаходження в природі,добування металів ІІ А групи.Добування.Солі Магнію та лужноземельних металів: властивості та використання їх в медицині.
……….
БІЛЕТ № 29
1. Ізомерія комплексних сполук
Комплексним сполукам властива ізомерія. Найпоширеніші види ізомерії коротко схарактеризовано нижче.
Гідратна ізомерія полягає в різному розміщенні молекул води у внутрішній і зовнішній координаційних сферах. Наприклад, формулі СrСl3×6Н2О відповідають три комплексні сполуки: [Сr(Н2О)6]С13 — фіолетового кольору, [Сr(Н2О)5С1]С12×Н2О — світло-зеленого і [Сr(Н2О)4С12]С1×2Н2О — темно-зеленого кольору.
Іонізаційна ізомерія полягає в різному розміщенні іонів у внутрішній і зовнішній сферах. Наприклад, формулі Со(NН3)3Вr×SO4 відповідають дві комплексні сполуки: [Со(NН3)5Вr]SО4, з розчину якої легко осаджується ВаSО4 і важко — АgВr, і [Со(NH3)5SО4]Вr, з розчину якої, навпаки, легко oсаджується АgВr і важко — ВаSО4.
Координаційна ізомерія, за якої комплексоутворювачі немовби обмінюються лігандами:
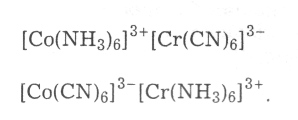
Ізомерія зв'язку. Деякі ліганди, наприклад іони СN-, NCS-, NO2-, мають по два донорні атоми і можуть координуватися різними способами, тобто є амбідентатними лігандами. Так, іон NO2- може координуватись як атомом Нітрогену, так і атомом Оксигену. У першому випадку утворюються нітрокомплекси [Co(NH3)5NO2]Br2, у другому — нітритокомплекс [Co(NH3)5ONO]Br2. Стійкішим у цьому є нітрокомплекс, нітритокомплекс мимовільно перетворюється на нітрокомплекс.
Геометрична ізомерія полягає в різному просторовому положенні лігандів відносно комплексоутворювача. Вона властива різнолігандним комплексним сполукам з квадратно-площинною або октаедричною (чи біпірамідальною) структурою, наприклад [Р1(NН3)2С12]
Оптична ізомерія характерна для різнолігандних або хелатних комплексних сполук, у цьому разі один ізомер є дзеркальним відбитком іншого. Оптичні ізомери утворюються одночасно в однакових кількостях і складають рацемічну суміш.
2.Загальна характеристика Стануму та Плюмбуму.Властивості олова і свинцю та їх сполуки. Застосування в медицині та біогенна роль.
Станум не належить до числа поширених металів, але воно легко виплавляється з руд і тому стало відомим людині у вигляді його сплавів з купрумом (бронзи) ще в глибоку давнину. Станум звичайно трапляється у вигляді кисневої сполуки SnO2 - каменю стануму, з якого і добувають його за допомогою відновлення вугіллям.
У вільному стані станум -- сріблястобілий м'який метал. При згинанні палички стануму чути характерний тріск, зумовлений тертям окремих кристалів між собою. Станум м'який, тягучий, його можна легко прокатати в тонкі листи, що називаються олов'яною фольгою або станіолем.
Крім звичайного білого стануму, що кристалізується в тетрагональній системі, існує друга видозміна стануму -- сірий станум --, що кристалізується в кубічній системі і має меншу густину. Біле станум стійке при температурах вище за 14° С, а сіре -- при температурах нижче за 14° С. Тому при охолодженні білий станум перетворюється в сірий. У зв'язку із значною зміною густини метал при цьому розсипається на сірий порошок. Це явище дістало назву олов' яної чуми. Найшвидше білий станум перетворюється в сірий при температурі близько --30° С; цей процес прискорюється при наявності зародків кристалів сірого стануму.
На повітрі станум при кімнатній температурі не окислюється, але нагріте вище від температури плавлення поступово перетворюється в діоксид стануму SnO2.
Вода не діє на станум. Розбавлені хлоридна і сульфатна кислоти діють на нього дуже повільно, що пояснюється великим перенапруженням виділення гідрогену на цьому металі. Концентровані розчини цих кислот, особливо при нагріванні, розчиняють станум. При цьому в хлорид ній кислоті утворюється хлорид стануму (ІІ), а в сірчаній -- сульфат стануму (IV):
Sn + 2НС1 = SnCl2 + H2 |
Sn + 4H2SO4 = Sn (SO4)2 + 2SO2 | + 4H2O.
З нітратною кислотою станум взаємодіє тим інтенсивніше, чим вищі концентрація кислоти і температура. В розбавленій кислоті утворюється розчинний нітрат стануму (ІІ):
4Sn + 10HNO3 = 4Sn (NO3)2 + NH4NO3 + 3H2O,
а в концентрованій -- сполуки стануму (IV), головним чином, нерозчинна ?-станатна кислота, склад якої приблизно відповідає формулі H2Sn03:
Sn + 4HNO3 = H2Sn031 + 4NO21 + H2O.
Концентровані луги також розчиняють станум. При цьому утворюються станіти -- солі станистої кислоти H2Sn02:
Sn + 2NaOH = Na2Sn02 + H21.
У розчинах станіти існують в гідратованих формах, утворюючи гідроксостаніти, наприклад:
Na2Sn02 + 2Н2О = Na2 [Sn (OH)4]
На повітрі стануму вкривається тонкою оксидною плівкою, що має захисну дію. Тому в умовах несильного корозійного впливу воно є хімічно стійким металом. Близько 40% всього стануму, яке виплавляють, витрачається на покриття ним виробів із заліза, які контактують з продуктами харчування, насамперед консервних банок. Це пояснюється зазначеною хімічною стійкістю стануму, а також тим, що його легко наносити на залізо і що продукти його корозії нешкідливі.
Станум утворює стійкі сполуки, у яких має ступінь окислення +2 і +4.
Сполуки стануму (II). Оксид стануму (II), або окис стануму, SnO -- темнобурий порошок, що утворюється при розкладанні гідроксиду стануму (II)Sn(OH)2 в атмосфері діоксиду карбону.
Гідроксид стануму (II) Sn (OH)2 утворюється у вигляді білого осаду при дії лугів на солі стануму (II):
Sn2+ + 2ОН- = Sn (OH) 2|
Гідроксид стануму (II) -- амфотерна сполука. Він легко розчиняється у кислотах і лугах, в останньому випадку з утворенням гідроксостанітів:
Sn (ОН)2 + 2NaOH = Na2 [Sn (ОН)4].
Хлорид стануму (II) SnCl2 * 2Н2О утворює безбарвні кристали. При нагріванні або значному розбавлянні розчину хлориду стануму (II) водою він частково гідролізується з утворенням осаду основної солі:
SnCl2 + Н2О = SnOHCl |+ НС1.
Хлорид стануму (II) -- відновник. Так, хлорид феруму (III) FeCl3 відновлюється ним у хлорид феруму (II) FeCl2:
2FeCl3 + SnCl2 == 2FeCl2 + SnCl4.
Сполуки стануму (IV). Діоксид (або двоокис) остануму SnO2 зустрічається в природі і його можна добути штучно спалюванням металу на повітрі або окисленням його нітратною кислотою з дальшим прожарюванням добутого продукту. Діоксид стануму застосовують для виготовлення білих полив та емалей.
Гідроксиди стануму (IV) називаються станатними кислотами.
Гідрид стануму SnH4 -- безбарвний, дуже отруйний газ. Він зріджується при --52° С, а при кімнатній температурі поступово розкладається на стануму і гідрогену.
Найважливіша руда, з якої добувають плюмбум, -- плюмбумний блиск PbS.
Перша металургійна операція при добуванні плюмбуму -- це випалювання, під час якого сульфід плюмбуму перетворюється в оксид:
PbS + ЗО2 = 2РЬ0 + 2SO2.
Плюмбум -- голубувато-білий важкий метал, дуже м'який -- його можна різати ножем.
Плюмбум широко використовують у техніці. Найбільше його витрачають на виготовлення оболонок кабелів та пластин акумуляторів. Плюмбум добре поглинає проміння.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!