
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальні гази. Газ Ван-дер-Ваальса
|
|
|
|
6.5. Знайти критичну густину води, якщо критичний тиск для води дорівнює Pкр =218.3 атм, а критична температура Ткр =647.3 К, припускаючи, що вода підкоряється рівнянню Ван-дер-Ваальса.
6.7. Якщо температура газа нижче так званої температури Бойля, то при ізотермічному стисненні його добуток PV спочатку спадає, проходить через мінімум, а потім починає наростати. Якщо ж температура газа вище температури Бойля, то при ізотермічному стисненні добуток PV монотонно наростає. Впевнитися в цьому та виразити температуру Бойля через критичну температуру для газа, який підкоряється рівнянню Ван-дер-Ваальса.
6.15. Як вперше було показано Столєтовим (1892 р.), для приведення рідини, заключеної в даний об’єм, в критичний стан повинна бути взята певна її кількість. Розглянути наступний приклад. Посудина, об’єм якої V1 =15 см3, повинен бути наповнений водою при температурі t1 =18 ºC з таким розрахунком, щоб при її нагріванні в даній посудині (попередньо відкачаному та запаяному) до критичної температури в ній встановився критичний тиск. В припущенні, що вода підкоряється рівнянню стану Ван-дер-Ваальса, знайти, який об’єм води повинен бути налитий в посудину, якщо відомо, що критична температура води Ткр =647.3 К, критичний тиск Pкр =218.3 атм, молярна маса m=18 г/моль, густина при 18ºС рівна r=1г/см3.
6.24. Два балона з об’ємами V1 = V2 =V=1 л з’єднані трубкою з краном. В об’ємі V1 знаходиться повітря під атмосферним тиском, а об’єм V2 відкачаний до граничного вакууму. Рахуючи, що повітря підкоряється рівнянню Ван-дер-Ваальса, а стінки балонів та трубки адіабатичні, визначити, на скільки зміниться температура газу після відкриття крану. Початкова температура T =290K, для повітря a =1.31×106 атм×см6/моль2.
|
|
|
6.35. Для газа Ван-дер-Ваальса знайти рівняння процеса, для якого є постійною його внутрішня енергія. Як молярна теплоємність для цього процесу залежить від температури T, якщо молярна теплоємність CV відома?
6.45. Один моль азота стиснений при температурі 0ºС до об’єму, рівного 1 л. Знайти зміну його ентропії при розширенні без підводу тепла і без виконання роботи до атмосферного тиску. Критична температура азота рівна -147ºС, а його критичний об’єм складає 0.092 л/моль. Рахувати, що в стисненому стані азот підкоряється рівнянню Ван-дер-Ваальса, а в розширеному веде себе як ідеальний газ. Теплоємність CV вважати не залежною від температури.
6.59. У вертикальному циліндрі під поршнем масою M і площею σ знаходиться один моль газа Ван-дер-Ваальса, сталі a та b якого відомі. Знайти період малих коливань поршня τ навколо положення рівноваги, рахуючи процес стиску та розрідження ізотермічним, причому T=Tкр. Рівноважний об’єм газа в умовах досліду прийняти рівним критичному.
6.64. Визначити ККД цикла, який складається з двох ізохор з об’ємами V1 та V2 та двох адіабат. Робочим тілом є газ Ван-дер-Ваальса, сталі a та b якого задані, а теплоємність CV не залежить від температури.
6.73. Вирахувати, в скільки разів відрізняються зміни температури при ефекті Джоуля-Томсона та при зворотньому адіабатичному розширенні газа Ван-дер-Ваальса. Перепад тиску в обох випадках однаковий і невеликий, Tкр / T =0.4 та Vкр/V =0.09, де Tкр та Vкр – критичні температура та об’єм.
В к а з і в к а. Коефіцієнт теплового розширення 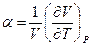 знаходиться диференціюванням рівняння Ван-дер-Ваальса.
знаходиться диференціюванням рівняння Ван-дер-Ваальса.
6.77. Визначити зміну внутрішньої енергії одного моля реального газа, який підкоряється рівнянню  при ізотермічному розширенні з температурою від Т об’єма V1 до об’єма V2. Сталі a та b відомі.
при ізотермічному розширенні з температурою від Т об’єма V1 до об’єма V2. Сталі a та b відомі.
6.79. Знайти зміну теплоємності  одного моля гелію при ізотермічному розширенні від об’єму V1=0.5 л до об’єму V2=1 л при температурі Т=10К. Рахувати, що газ підкоряється рівнянню Бертло:
одного моля гелію при ізотермічному розширенні від об’єму V1=0.5 л до об’єму V2=1 л при температурі Т=10К. Рахувати, що газ підкоряється рівнянню Бертло: 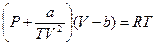 , в якому для гелія
, в якому для гелія 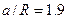 л×К2/моль.
л×К2/моль.
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!