
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое сродство
|
|
|
|
При решении задач этого раздела см. табл.4 приложения.
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре идет в обратном направлении, т.е. с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), уменьшению Н, с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая растет с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, H, V обладают аддитивными свойствами, т.е. при соприкосновении систем суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, сжатие, упрочнение связей, полимеризация и т.п. – ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение ΔSзависит только от начального S1 и конечного S2состояния и не зависит от пути процесса
ΔS 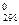 =ΣniS
=ΣniS 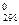 прод – ΣnjS
прод – ΣnjS 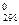 исход
исход
ΔS = S2 – S1. Если S2 > S1, то S1> 0. Если S2 < S1,то S1< 0.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка ≈ТΔS.Энтропия выражается в Дж/моль∙К.Таким образом, движущая сила процесса складывается из двух сил: стремление к упорядочению Н и стремление к беспорядку ТS. При Р = const и Т = constобщую движущую силу процесса, которую обозначают ΔG, можно найти из соотношения:
|
|
|
ΔG = (Н2 – Н1) – (ТS2 – ТS1) = ΔН – ТΔS;
ΔG = ΔН – ТΔS.
Величина G называется изобарно-изотермическим потенциалом, или энергией Гиббса. Итак, мерой химического сродства является убыль G потенциала или ΔG, которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
ΔG 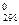 =ΣniG
=ΣniG 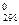 прод – ΣnjG
прод – ΣnjG 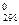 исход.
исход.
Самопроизвольно протекающие процессы идут в сторону уменьшения любого потенциала и, в частности, в сторону уменьшения ΔG. Если ΔG < 0– процесс принципиально возможен, если ΔG > 0– процесс самопроизвольно проходить не может. Чем меньше ΔG, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором ΔG = 0и ΔG = ТΔS.
Из соотношения ΔG = ΔН – ТΔSвидно, что самопроизвольно могут протекать и процессы, для которых ΔН > 0(эндотермические). Это возможно, когда ΔS > 0, но | ТΔS| > |ΔН|, и тогда ΔG < 0. С другой стороны, экзотермические реакции (ΔН <0)самопроизвольно не протекают, если при ΔS < 0 окажется, что ΔG > 0.
Пример 1. Что имеет большую энтропию: 1 моль кристаллического вещества или 1 моль его паров при той же температуре?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 476; Нарушение авторских прав?; Мы поможем в написании вашей работы!