
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коллигативные свойства растворов
Коллигативными называют такие свойства раствора, которые зависят только от концентрации растворенного вещества и природы растворителя, но не зависят от природы растворенного вещества. К этим свойствам относятся: 1) понижение давления насыщенного пара над раствором; 2) понижение температуры замерзания; 3) повышение температуры кипения; 4) осмотическое давление.
Давление насыщенного пара при данной температуре характеризует равновесие между жидким и газообразным состоянием вещества в закрытой системе, возникающее на границе раздела фаз вследствие выравнивания скоростей эндотермического процесса испарения и экзотермического процесса конденсации. В растворе концентрация молекул растворителя в поверхностном слое меньше, чем в чистом растворителе (молекулы растворенного вещества сольватируясь (гидратируясь) занимают часть поверхности раствора), поэтому равновесие достигается при меньшем давлении насыщенного пара. Выражение Р0 – РА = ΔРА = Р0А∙NB количественно выражает связь между концентрацией растворенного вещества в растворе и давлением насыщенного пара растворителя над раствором. Его называют законом Рауля: понижение давления насыщенного пара растворителя А над раствором ∆РА пропорционально мольной доле растворенного нелетучего вещества Nв.
Здесь Р0А и РА — давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ∆РА – разность между давлениями насыщенного пара растворителя над раствором РА и растворителем Р0А.
Из выражения закона Рауля следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипениярастворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя.
Повышение температуры кипения ∆Ткип. пропорционально моляльности раствора: ΔТкип = Кэ∙Сm,
где Кэ — эбуллиоскопическая постоянная. Она означает повышение температуры кипения раствора при его моляльной концентрации, равной 1.
Вспомнив определение моляльности раствора, можно записать:
∆Ткип. = Кэ mр.в.·1000/М·mр-ля.
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температуры замерзания(кристаллизации) чистого растворителя.Раствор замерзает при более низкой температуре, чем растворитель, так как молекулы растворенного вещества при понижении температуры препятствуют формированию кристаллической решетки при затвердевании раствора.
Понижение температуры замерзания (кристаллизации) ∆Тзам. пропорционально моляльности раствора:
ΔТкип = Кк∙Сm, или ∆Тзам. = Кк mр.в.·1000/М·mр-ля,
где Кк — криоскопическая постоянная, которая означает понижение температуры затвердевания раствора при его моляльной концентрации, равной 1.
Значения Кэ и Кк зависят от природы растворителя и не зависят от природы растворенного вещества и его концентрации.
Значения Кэ и Кк — справочные величины.
Осмотическим называется давление, под которым растворитель поступает в раствор, отделенный от растворителя полупроницаемой мембраной, которая не способна пропускать молекулы растворенного вещества, но пропускает молекулы растворителя.
Оно рассчитывается по формуле (закон Вант-Гоффа)
π = СМRT = 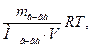
где π – осмотическое давление, Па, кПа, атм, мм.рт.ст.; R = 8,314 Дж/моль∙К – универсальная газовая постоянная; Т = t + 2730 - абсолютная температура, К; mв-ва, Мв-ва – масса и молярная масса растворенного вещества, г; V – объем раствора, л.
|
|
Дата добавления: 2015-05-26; Просмотров: 821; Нарушение авторских прав?; Мы поможем в написании вашей работы!