
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства дисперсных систем
|
|
|
|
Дисперсные системы – это гетерогенные системы, которые состоят, по крайней мере, из двух составляющих: дисперсной фазы (д.ф.) и дисперсионной среды (д.с.). Дисперсную фазу (д.ф.) составляют раздробленные частицы (т.е. более крупные частицы), равномерно распределенные в дисперсионной среде. Дисперсионная среда (д.с.) – это та среда, в которой равномерно распределены частицы дисперсной фазы.
Размеры частиц дисперсной фазы варьируют в широком диапазоне: в высокодисперсных системах, которые называют коллоидно-дисперсными (золи), - от 10-9 до 10-7 м (частицы с размером меньше 10-9 м образуют истинные растворы); в грубодисперсных системах (эмульсии, суспензии) – от 10-7 до 10-5 м.
Дисперсную фазу в коллоидных растворах составляют частицы со сложной структурой. Их называют – мицеллы.
Рассмотрим процесс образования мицеллы коллоидного раствора хлорида серебра AgCl. Этот гидрозоль образуется при медленном приливании водного раствора NaCl к водному раствору AgNO3, взятому в избытке:
NaCl + AgNO3(изб) = AgCl↓ + NaNO3.
Если ввести сразу большую порцию раствора NaCl, то мгновенно выпадает осадок AgCl и золь не получится. При постепенном введении раствора NaCl в раствор AgNO3 в системе в первый момент образуются микрокристаллики хлорида серебра, каждый из которых является агрегатом, состоящим из некоторого числа молекул n молекул AgCl.Агрегаты (AgCl)nадсорбируют на своей поверхности те ионы, которые составляют кристаллическую решетку и находятся в растворе в избытке (согласно правилу Фаянса-Панета). Этим условиям отвечают ионы Ag+. В результате адсорбции ионов Ag+ кристаллические агрегаты хлорида серебра приобретают положительный заряд. Ионы, адсорбирующиеся на поверхности кристаллического агрегата, называют потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствуетих объединению иросту кристаллов AgCl. Агрегаты AgCl с адсорбированными на их поверхности ионами приобретают состояние агрегативной устойчивости. Кристаллический агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag+ составляет ядро.
|
|
|
К заряженному ядру притягиваются ионы противоположного заряда – противоионы. Для данной системы раствор AgNO3 - кристалл AgCl противоионами будут нитрат-ионы NO 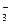 . Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов. За этим слоем следует диффузный слой тех же противоионов.
. Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов. За этим слоем следует диффузный слой тех же противоионов.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Коллоидная частица совместно с противоионами диффузного слоя называется мицеллой. Коллоидная частица всегда заряжена, знак заряда соответствует знаку заряда потенциалопределяющих ионов; мицелла в отличие от гранулы электронейтральна.
Формула мицеллы гидрозоля хлорида серебра записывается так 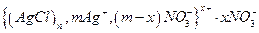
(в фигурные скобки заключена гранула). Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Эти ионы под действием электрического поля отрываются от мицеллы, и к отрицательно заряженному электроду будет передвигаться гранула, заряд которой определяется ионами серебра, входящими в ядро.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если взять избыток NaCl, то на поверхности агрегата будут адсорбироваться хлорид-ионы, имеющиеся в растворе, а в качестве противоионов адсорбционного и диффузного слоев будут выступать ионы натрия  .
.
Во внешнем электрическом поле отрицательно заряженная гранула перемещается к положительно заряженному электроду.
Процесс потери агрегативной устойчивости коллоидного раствора, сопровождающийся укрупнением частиц, называют коагуляцией.
|
|
|
Коагуляцию могут вызывать различные внешние воздействия: добавление небольших количеств электролита, концентрирование коллоидного раствора, изменение температуры, действие ультразвука, встряхивание, перемешивание и т.д. Сущность коагуляции состоит в нейтрализации заряда гранулы.
Для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции, или пороговой концентрацией (СПК). Величина, обратная порогу коагуляции, называется коагулирующей способностью:
 .
.
Существуют следующие правила коагуляции электролитами:
1. Коагуляцию вызывают ионы, которые имеют знак заряда, противоположный знаку заряда гранул. Коагуляцию положительно заряженных ионов вызывают анионы, отрицательно заряженных – катионы.
2. Коагулирующее действие ионов тем сильнее, чем выше заряд иона коагулянта (правило Шульце-Гарди)
РAl3+ > PCa2+ > PK+; PPO 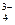 > PSO
> PSO  > PCl-.
> PCl-.
3. Для ионов одного заряда коагулирующая способность зависит от радиуса сольватированного иона: чем больше радиус, тем больше коагулирующая способность
PCs+ > PRb+ > PK+ > PNa+ > PLi+; PCNS- > PI- > PBr- > PCl-.
Пример 1. Золь иодида серебра получен смешиванием раствора нитрата серебра объемом 20 мл с концентрацией 5,0∙10-3 моль/л и раствора иодида калия объемом 30 мл с концентрацией 6,0∙10-3 моль/л. Укажите: а) метод и способ получения коллоидного раствора; б) потенциалопределяющие ионы, противоионы; в) формулу мицеллы, назвать ее составные части; г) знак заряда золя; д) к какому электроду будет перемещаться дисперсная фаза при электрофорезе; е) какой ион электролита KNO3 будет вызывать коагуляцию?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1551; Нарушение авторских прав?; Мы поможем в написании вашей работы!