
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Одержання оцтово етилового естеру
|
|
|
|
4.9.1. Хід роботи: в суху пробірку кладуть трошки обезводненого порошку натрій ацетату (висота шару 1 – 1,5 мм) і три краплі етилового спирту. Додають 2 краплі сульфатної кислоти і обережно нагрівають над полум’ям пальника.
4.9.2. Спостереження: з’являється характерний свіжий запах оцтового ефіру.
4.9.3. Хімізм реакцій:

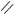 О O
О O

 R – С + Н2SO4 → R – C + NaHSO4
R – С + Н2SO4 → R – C + NaHSO4
NaO OH
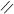

 О Н+ О
О Н+ О

 R – С + R’ – ОН D R – С + Н2О
R – С + R’ – ОН D R – С + Н2О
OН ОR
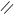
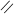 О О
О О

 СН3 – С + С2Н5ОН D СН3 – С + Н2О
СН3 – С + С2Н5ОН D СН3 – С + Н2О
ОН ОС2Н5
4.9.4. Висновок: важливим способом отримання складних ефірів є взаємодія карбонових кислот із спиртами, каталізатором є сульфатна кислота.
4.10.Взаємодія оцтового ангідриду з водою.
4.10.1. Хід роботи: в пробірку поміщають 5 крапель води 2 краплі оцтового ангідриду і збовтують. Оцтовий ангідрид у воді не розчиняється. Обережно нагрівають вміст пробірки на полум’ї пальника.
4.10.2. Спостереження: до нагрівання оцтовий ангідрид у воді нерозчинний, тому після відстоювання суміш розшаровується – оцтовий ангідрид утворює нижній шар, і після нагрівання рідина стає однорідною.
 О
О

 4.10.3. Хімізм реакцій: СН3 – С О
4.10.3. Хімізм реакцій: СН3 – С О

 О + НОН → 2СН3 – С
О + НОН → 2СН3 – С
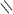 СН3 – С ОН
СН3 – С ОН
О
4.10.4. Висновок: ангідриди реагують з водою тільки при нагріванні.
4.11.Взаємодія оцтового ангідриду з лугом.
4.11.1. Хід роботи: поміщаємо в пробірку 5 крапель води, додають 2 краплі оцтового ангідриду і 2 краплі розчину їдкого натрію.Енергійно збовтують.
4.11.2. Спостереження: утворився однорідний розчин.
4.11.3. Хімізм реакцій:
 О
О

 СН3 – С O
СН3 – С O

 О + 2NaOH → 2CH3 – C + H2O
О + 2NaOH → 2CH3 – C + H2O
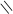 СН3 – С ONa
СН3 – С ONa
О
4.11.4. Висновок: з лугами реакція йде краще.
4.12.Одержання фенолфталеїну.
4.12.1. Хід роботи: в суху пробірку поміщають декілька кристалів фталевого ангідриду і 3 краплі рідкого фенолу. додають 1 краплю Н2SO4. Зміст пробірки нагрівають над полум’ям до сплавлення суміші. Суміш охолоджують і додають 5-6 крапель води. Наносять краплю розчину на кусок фільтрувального паперу, а коли крапля всмокчеться, поміщають в центрі плями і краплю розчину їдкого натрію.
|
|
|
4.12.2. Спостереження: при сплавленні суміш забарвлюється в темно-червоний колір, після додавання гідроксиду натрію на папері з’являється малиново-червона пляма.
4.12.3. Хімізм реакцій:








 НО ОН НО ОН
НО ОН НО ОН




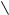
 О [H2SO4] С
О [H2SO4] С


 О
О




 С - H2O
С - H2O

 О С
О С
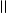
 С
С
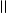
 О
О
О
4.12.4. Висновок: фенолфталеїн отримують конденсацією фталевого ангідриду з фенолом в присутності сульфатної кислоти.
4.13. Розчинність мила у воді.
4.13.1. Хід роботи: в пробірку поміщають кусочок мила (10мг) і добавляють 5 крапель води і збовтують вміст пробірки протягом 1-2 хв. Після цього вміст пробірки нагрівають на полум’ї пальника. Нагрівають і інші лужні мила (калієві, алюмінієві), які добре розчиняються у воді.
4.13.2. Спостереження: мило добре розчинне у воді.
4.13.4. Висновок: натрієве та інші лужні мила добре розчинні у воді.
4.14.Виділення вільних жирних кислот із мила.
4.14.1. Хід роботи: в пробірку поміщають 5 крапель концентрованого розчину мила, добавляють одну краплю р-ну H2SO4 і злегка підігрівають вміст пробірки на полум’ї пальника. Спливає білий маслянистий шар вільних жирних кислот, водний розчин освітлюється. Вміст пробірки залишають для наступних дослідів.
4.14.2. Спостереження: спливає білий маслянистий шар вільних жирних кислот, водний розчин освітлюється.
4.14.3. Хімізм реакцій:
С17Н35 – СООNa + Н2SО4 → С17Н35 – СООН + NaSO4
4.14.4. Висновок: мила – це солі вищих насичених і ненасичених органічних кислот. Тверде мило – це суміш натрієвих солей пальмітинової, стеаринової і олеїнової кислоти.
4.15.Гідроліз спиртового розчину мила.
4.15.1. Хід роботи: в суху пробірку кладуть кусочок мила, 4 краплі спирту, енергійно збовтують і добавляють одну краплю фенолфталеїну.
|
|
|
Колір не змінюється. До спиртового розчину добавляють по краплях дистильовану воду.
4.15.2. Спостереження: по мірі додавання дистильованої води з’являється рожеве забарвлення, його інтенсивність поступово збільшується.
4.15.3. Хімізм реакцій:
С17Н35СООNa + HOH → C17H35COOH + NaOH
С17Н35СООNa D [C17H35COO]- + Na+
[C17H35COO]- + НОН → C17H35COOH + ОН-
4.15.4. Висновок: розбавлення спиртового розчину мила водою викликає гідроліз мила. В результаті утворюються малодисоційовані жирні кислоти і натрій гідроксид. Рожеве забарвлення говорить про появу в розчині гідроксильних іонів. Реакція водних розчинів мила завжди лужна.
4.16.Утворення нерозчинних кальцієвих солей жирних кислот.
4.16.1. Хід роботи: в пробірку поміщають дві краплі розчину мила, одну краплю розчину хлориду кальцію і збовтують вміст пробірки.
4.16.2. Спостереження: випадає білий осад.
4.16.3. Хімізм реакцій:
2С17Н35СООNa + CaCl2 → (C17H35COO)2Ca + 2NaCl
4.16.4. Висновок: кальцієві солі жирних кислот (кальцієве мило) нерозчинні у воді. Кальцієве мило виділяється при митті в жорсткій воді.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 938; Нарушение авторских прав?; Мы поможем в написании вашей работы!