
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
V. Водородная связь
|
|
|
|
IV. Металлическая связь
Очень прочная (у большинства металлов высокие t°пл).
Кристаллическая решетка отличается от ионной: в узлах находятся (+) заряженные ионы или нейтральные атомы, а свободные  легко передвигаются между узлами, называются «электронный газ» и объясняют основное свойство металлов - электропроводность: направленное движение свободных электронов.
легко передвигаются между узлами, называются «электронный газ» и объясняют основное свойство металлов - электропроводность: направленное движение свободных электронов.
Самые электропроводные: Аu, Ag, Сu, Fe, AI.
При повышении t° увеличивается хаотическое движение атомов и ионов в узлах решеток, и это мешает направленному движению  - т.е. увеличивается сопротивление и уменьшается электропроводность.
- т.е. увеличивается сопротивление и уменьшается электропроводность.

Очень слабая, но важна для биологии. Образуется между атомами Н одной молекулы и электроотрицательными атомами другой молекулы.
Природа сил:
1) электростатическая;
2) донорно-акцепторная.
Примеры:
1) В молекуле HF ковалентная полярная связь, молекулу можно представить в виде диполя
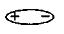
Так как молекулы сильно поляризованы, между ними возникает притяжение прежде всего за счет электростатических сил. И в отличие от HCl, единичных молекул HF нет, а известны «ассоциаты» Н2 F2, …, H6 F 6

Это сказывается на химических свойствах плавиковой кислоты: в отличие от других кислот типа НГал, плавиковая кислота является слабой (диссоциация затруднена из-за межмолекулярного взаимодействия):

2) Рассмотрим молекулу Н2О. Сравним соединения Н2О и H2S (на основании положения кислорода и серы в Периодической системе соединения Н2О и H2S должны быть похожи).  = 18 г/моль,
= 18 г/моль,  = 34 г/моль, однако при обычных условиях Н2О - жидкость, a H2S - газ. Почему так, а не наоборот? По-видимому,
= 34 г/моль, однако при обычных условиях Н2О - жидкость, a H2S - газ. Почему так, а не наоборот? По-видимому,  на самом деле значительно больше 18 г/моль. Это возможно только в том случае, если при обычных условиях Н2О существует не в виде единичных молекул, а объединяется в ассоциаты. Сравним кислород и серу: кислород более электроотрицателен, чем сера. Значит связи Н-О более полярны, чем Н-S и между молекулами Н2О легко образуются водородные связи:
на самом деле значительно больше 18 г/моль. Это возможно только в том случае, если при обычных условиях Н2О существует не в виде единичных молекул, а объединяется в ассоциаты. Сравним кислород и серу: кислород более электроотрицателен, чем сера. Значит связи Н-О более полярны, чем Н-S и между молекулами Н2О легко образуются водородные связи:
|
|
|

Установили, что единичные молекулы Н2О встречаются только при высокой температуре (в перегретом паре). А в жидком состоянии существуют ассоциаты (Н2О)8, (Н2О)6, (Н2О)4 и др.
Также установлено, что несмотря на многообразие рисунков у снежинок, они изначально кристаллизуются в форме тетраэдра: одна молекула воды окружена четырьмя другими за счет образования водородных связей.
V1. Силы Ван-дер-Ваальса (Межмолекулярные взаимодействия)
Это взаимодействия молекул между собой, не приводящие к разрыву или образованию новых химических связей. Основу составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой молекулы; силы действуют между всеми молекулами, находящимися на близком расстоянии одна от другой. Особенно характерны для газов.
Межмолекулярное взаимодействие усиливается при увеличении внешнего давления и уменьшении температуры. Эти силы очень слабые, поэтому какая-либо молекула случайно может оказаться достаточно возбужденной, чтобы оторваться от соседних и вылететь в окружающее пространство. Так, например, даже твердые вещества могут испаряться.
Метод молекулярных орбиталей (МО)
Развили этот метод Р. Малликен и Ф. Гунд, он дополняет и углубляет метод валентных связей. Квантово-механические закономерности, установленные для атомов, распространяются на молекулу:
1.При образовании молекул имеет место не механическое перекрывание орбиталей, а валентные электроны с атомных орбиталей(АО) переходят на молекулярные орбитали (МО), новые по энергии и форме.
2.Из двух исходных атомных получают две молекулярные орбитали, одна из которых энергетически более выгодна и называется “связывающей”, а другая не выгодна по сравнению с атомной и называется “разрыхляющей”.
|
|
|
3.Устойчивость молекулы оценивается по величине порядка связи (ПС):
ПС = 
Если ПС =1(и больше), то молекула устойчива
ПС = 0,5 – молекула неустойчива
ПС = 0 - молекулы не существует
4.Для молекул, образованных неметаллами, значение рассчитанной величины ПС совпадает с величиной кратности связи, определенной по методу валентных связей. Однако метод МО позволяет доказать существование молекул Li2, C2, заряженных частиц 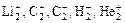 и др.
и др.
5.Метод объясняет наличие магнитных свойств у многих молекул (например жидкий кислород – парамагнетик):
а)если на всех молекулярных орбиталях находятся только спаренные электроны, то вещество – диамагнетик;
б)если на молекулярных орбиталях имеется хотя бы один неспаренный электрон (неважно, на связывающих или разрыхляющих) – то вещество парамагнетик.
Вопросы для закрепления материала:
1.Какой тип связей существует в молекулах HNO3? KNO2?
2.Какая из указанных молекул имеет наиболее ковалентный характер связи – а)LiCI? б) NaH? в) KCI?
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ОКСИДЫ – соединения, состоящие из двух элементов, один из которых кислород.
Делятся на солеобразующие: основные(о.оксиды) - К2О, CaO; кислотные (к.оксиды) - CO2, SО3; амфотерные (ZnO, MnO2);
несолеобразующие: просто оксиды(CO, NO) и пероксиды (H2O2, BaO2, CrO5).
Основные оксиды образованы металлами:
1.щелочными или щелочно-земельными металлами (Li, Na, К, Rb, Cs, Fr, Ca, Sr, Ba);
2.элементами побочных подгрупп в минимальной степени окисления (FeO, CrO, MnO).
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 821; Нарушение авторских прав?; Мы поможем в написании вашей работы!