
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
I. Метод валентных связей
|
|
|
|
Природа сил комплексообразования
Номенклатура комплексных соединений
1. Молекулу называют слева направо в именительном падеже.
2. При названии комплексного иона вначале называют лиганды, а затем центральный ион.
3. Лиганды (если они разные) называют в алфавитном порядке с использованием греческих приставок (ди-, три-, тетра-, …).
4. а) Если лиганд – нейтральная молекула, то его называют без окончания
(H2O – «аква», NH3 – «аммин», СО – «карбонил», NO – «нитрозо»).
б) Если лиганд заряжен, то используют окончание «о»
(F - - «фторо», ОН - - «гидроксо», …).
5. При назывании центрального атома применяют: а)русское название элемента, если комплекс катионный; б) греческое или латинское название, если комплекс анионный.
6. При назывании по Штоку после названия центрального атома указывают его валентность, а в названии по Эвенсу-Бассету указывают заряд комплексного иона.
Пример:
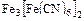 по Штоку: железо (II) гексацианоферрат (III);
по Штоку: железо (II) гексацианоферрат (III);
по Эвенсу-Бассету: железо (+2) гексацианоферрат (3-).
За счёт свободных d – орбиталей центральный ион, как правило, будет акцептором электронных пар, а лиганды являются донорами. Орбитали центрального атома гибридизуются, причём на тип гибридизации влияет число лигандов и их электронная структура. Характер гибридизации определяет структуру комплексного иона.

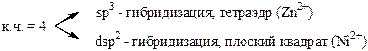
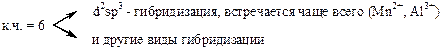
Иногда прочность связи усиливается благодаря появлению дативных связей (обратны донорно-акцепторным).
Пример:
Комплексное соединение содержит центральный ион  и лиганды
и лиганды  ;
; 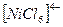 :
:


Таким образом, между  и
и 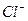 действуют связи:
действуют связи:
а) донорно-акцепторные;
б) дативные;
в) электростатические.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!