
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні закони ідеального газу
Для кращого розуміння властивостей газоподібного стану, на початку ХVІІІ ст.. Ломоносовим введено поняття «ідеального газу»:
Ідеальний газ – максимально розріджений стан газу, для якого характерні три ознаки:
S Молекули не мають власного розміру, тому їх розглядають як математичні точки.
S Між молекулами не існують сили міжмолекулярної взаємодії
S Молекули рухаються хаотично.
Будь-яку кількість газу можна охарактеризувати за допомогою трьох параметрів:
Ø Температура – характеризує інтенсивність руху молекул. Розрізняють дві одиниці вимірювання: 1К – теоретична (термодинамічна) температура, 1°C – одиниця вимірювання практичної температури (за допомогою термометра)
Ø 1Па – це тиск, який створює тіло на 1 см2 з силою 1Н. 1Па=1Н/1см2
Ø Об’єм –в системі сі в м3, але в хімії використовують літри.
1 літр = 10-3м3
1м3 = 1000 літрів.
І закон – Закон Бойля – Маріотта: Незалежно один від одного в 1662 році Бойль і в 1676р. Маріотт, на основі емпіричних досліджень сформулювали закон: для даної кількості ідеального газу при сталій температурі добуток тиску на об’єм є величина стала. Даний закон описує ізотермічний процес.
T=const. PV=const.
P1V1=P2 V2 (1)
P1/ P2=V2/V1 (2)
Графічно дана залежність матиме вигляд симетричної гіперболи, і називається ізотермою.
P=f(V)
T1<T2<T3
Для даної кількості ідеального газу при сталій температурі відношення тисків буде обернено пропорційне відповідним об’ємом газу.
P1V1=P2 V2 (1)
P1/ P2=V2/V1 (2)
Для даної кількості ідеального газу відношення густин (концентрацій) ідеального газу прямо пропорційне відповідними тискам газу.
ρ1/ρ2=Р1/Р2 (3)
с1/с2= Р1/Р2 (4)
Закон Гей – Люссака описує ізобарний процес Р=const.
Для даної кількості ідеального газу при сталому тиску при підвищенні температури на 1 °C приводить до підвищення на 1 / 273,16 його попереднього об’єму при 0 °C.
Vt=V0(1+ 1 / 273,16 t) (5)
Якщо 1 / 273,16 замінити на α то:
Vt=V0(1+ α t) (6)
Дана графічна залежність має лінійний характер і називається ізобарою.
V=f(T) при p=const. – ізобара P1>P2>P3
При переході до абсолютних температур:
Для даної кількості ідеального газу при сталому тиску відношення об’ємів газу прямо пропорційне відношенню відповідних абсолютних температур.
V1 / V2=T1 / T2 (8)
Відповідна графічна залежність матиме вигляд:
V=f(T) при P=const.
P1>P2>P3
Закон Шарля описує ізохорний процес: для даної кількості ідеального газу при сталому об’ємі підвищення температури на 1 °C призводить до підвищення на 1 / 273,16 його початкового тиску виміряного при 0 °C.
Pt=P0(1+1 / 273,16t) (9)
Якщо 1 / 273,16 замінити на β, то:
Pt=P0(1+βt) (10)
Графічна залежність матиме лінійний характер і називається ізохорою:
При переході до абсолютних температур:для даної кількості ідеального газу при сталому об’ємі відношення тисків газу буде рівне відношенню відповідних температур.
Р1/Р2=Т1/Т2 (11)
Характеризується графічною залежністю виду:
V1>V2>V3
Абсолютна температура – це температура початок якої відраховується від такого значення, прийнятого за 0К, при охолодженні до якого при сталому об’ємі тиск ідеального газу повинен бути рівний 0.
Для даної кількості ідеального газу при сталому об’ємі відношення густини (концентрації) ідеального газу обернено пропорційне абсолютним температурам.
ρ1/ρ2=Т2/Т1 (12)
с1/с2= Т2/Т1 (13)
Рівняння стану ідеального газу виведено н основі 3 попередніх законів:
PV/T=const.
P1V1/T1=P2V2/T2 (14)
Дане рівняння використовується для приведення параметрів газу до однакових умов:
PV /T=P0V0/T0 (15)
Де, P0,V0,T0 – параметри ідеального газу при початкових(нормальних) умовах.
ρ=1/V V=1/ρ
P/ρT=P0/ρ0T0 (16)
Закон Авогадро: одинакові об’єми різних газів за однакових умов містять однакову кількість молекул.
Авогадро ввів поняття нормальні умови: t=0 °C, або Т=273К, Р=101 325 Па, 1атм, 760 мм. рт. ст.
Об'єм виміряний при цих умовах позначається як V0
Авогадро вперше вводить поняття кількості речовини
ρ=m/M
ρ0=M/Vm ρ=M/22,4 (17)
V0=22,4/M (18)- питомий об’єм при нормальних умовах
Рівняння Менделєєва – Клапейрона для 1 моля ідеального газу:
PV=RT (19)
PV=nRT (20)
PV=  RT (21)
RT (21)
R – стала Рідберга, універсальна газова стала.
Фізичний зміст універсальної газової сталої - розширення 1 моля ідеального газу при сталому тиску при збільшенні температури на 1°C.
R=A/T2 – T1 (22)
Закони ідеальних сумішей газів
Ідеальні суміші теж описуються трьома ознакамиідеального газу.
Закон Дальтона: загальний тиск ідеальної суміші газів рівний сумі парціальних тисків його компонентів.
Pзаг=Р1+Р2+…….+Рі (23)
Парціальний тиск – це такий тиск, який створював би даний компонент суміші, як би він займав той самий об’єм, який займає ідеальна суміш.
Р1,Р2,Рі – парціальні тиски відповідних компонентів суміші.
Згідно рівняння Менделєєва – Клапейрона, для довільної кількості ідеального газу, відповідно для однокомпонентної суміші має вигляд:
P1V=nRT P1=n1RT/V (24)
де V –загальний об’єм суміші.
Т – температура, яка однаково впливає на всі компоненти суміші
n1 – кількість моль даного компонента суміші
P2=n2RT/V (25)
Pi=niRT/V (26)
Підставивши рівняння 24 – 26 у загальне рівняння 23, отримаємо вираз:
Рзаг= 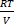 (n1+n2+……+ni) (27)
(n1+n2+……+ni) (27)
Закон Амага: загальний об’єм ідеальної суміші газів дорівнює сумі парціальних об’ємів його компонентів.
Vзаг=V1+V2+…Vi (28)
V1,V2,Vi - парціальні об’єми відповідних компонентів суміші
Їх величини розраховують згідно формул:
V1=n1RT/P (29)
V2=n2RT/P (30)
Vi=niRT/P (31)
Де Р – загальний тиск ідеальної суміші газів
Підставивши значення виразів 29 – 31 в рівняння 28отримаємовираз:
Vзаг=  (n1+n2+…ni)
(n1+n2+…ni)
Зв'язок R з теплоємністю:
R=CP – CV
CP – ізобарна теплоємність
CV – ізохорна теплоємність
|
|
Дата добавления: 2015-05-26; Просмотров: 5507; Нарушение авторских прав?; Мы поможем в написании вашей работы!