
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома
|
|
|
|
Периодический закон Д.И.Менделеева
Строение атома. Химическая связь
В 1869 году Д.И. Менделеев формулирует открытый им периодический закон:
«свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
В настоящее время вместо понятия «атомный вес» используется понятие «атомная масса».
Дальнейшее развитие естествознания, особенно учения о строении атома, показало, что индивидуальность химического элемента
определяется зарядом его ядра, а химические свойства элементов и
их соединений, периодическая повторяемость их у разных элементов определяются строением электронной оболочки атома, которая, в свою очередь, зависит от заряда ядра атома.
Современная формулировка периодического закона Д.И. Менделеева гласит:
«Свойства химических элементов, а также свойства и форма образуемых ими соединений, находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов».
Таким образом, для того, чтобы понять причину периодичности
свойств соединений химических элементов, надо обратиться к изучению строения атома.
Атом – это наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
По современным представлениям атом - это электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
В свою очередь ядро атома состоит из протонов, нейтронов (общее название - нуклоны) и большого числа других частиц. Электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента.
|
|
|
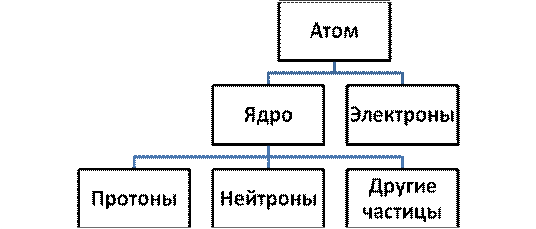
Рис. 4.1. Схема строения атома элемента
Протон 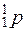 - положительно заряженная микрочастица с зарядом +1,6·10-19 К, условно принятым за единицу положительного заряда qр = +1. Масса протона близка к 1 а.е.м. Общее число протонов Np, входящих в состав ядра, определяет общий заряд ядра атома и его порядковый номер в Периодической системе элементов Д.И. Менделеева.
- положительно заряженная микрочастица с зарядом +1,6·10-19 К, условно принятым за единицу положительного заряда qр = +1. Масса протона близка к 1 а.е.м. Общее число протонов Np, входящих в состав ядра, определяет общий заряд ядра атома и его порядковый номер в Периодической системе элементов Д.И. Менделеева.
Нейтрон 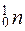 - электронейтральная микрочастица входящая в состав ядра атома. Его масса, как и масса протона, близка к 1 а.е.м.
- электронейтральная микрочастица входящая в состав ядра атома. Его масса, как и масса протона, близка к 1 а.е.м.
Нуклоны (от лат. nucleus – ядро, зерно, косточка) – собирательное название протонов и нейтронов – основных частиц, образующих атомные ядра.
Электрон ē - отрицательно заряженная микрочастица, входящая в состав атома и несущая наименьший электрический заряд -1,6×10-19 Кл. Для удобства величина этого «элементарного» заряда принята за единицу qe = -1. Так как атом в целом электронейтрален, то число электронов равно заряду ядра этого атома.
Например, заряд ядра атома натрия 11Na равен +11. Вокруг ядра размещается 11 электронов с общим отрицательным зарядом –11.
Основная масса атома (m) сосредоточена в его ядре, так как масса электронов мала и не вносит существенного вклада в массу всего атома. Масса электрона составляет лишь 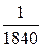 от массы протона или нейтрона.
от массы протона или нейтрона.
Масса атома, таким образом, фактически складывается исходя из масс всех протонов (Np) и нейтронов (Nn) и характеризуется массовым числом (А).
Массовое число атома какого-либо элемента (А) численно равно сумме масс общего числа протонов (Np) и общего числа нейтронов (Nn):
A = Np + Nn.
Например, у атома калия 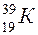 (порядковый номер в таблице Менделеева 19, массовое число равно 39) в ядре находится 19 протонов и 20 нейтронов, у атома бария
(порядковый номер в таблице Менделеева 19, массовое число равно 39) в ядре находится 19 протонов и 20 нейтронов, у атома бария 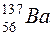 (порядковый номер 56, массовое число 137) в ядре 56 протонов и 71 нейтрон.
(порядковый номер 56, массовое число 137) в ядре 56 протонов и 71 нейтрон.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1669; Нарушение авторских прав?; Мы поможем в написании вашей работы!