
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная структура атома
 |
По своей природе электрон имеет двойственный характер: наряду с корпускулярными свойствами материальной частицы он также, подобно фотонам света, имеет волновые свойства, например, обладает способностью к дифракции.
В настоящее время описание состояния электрона в атоме дается
квантовой механикой, изучающей движение и взаимодействие элементарных частиц.
Электрон в атоме не имеет траектории движения. Следует рассматривать, так называемое, электронное облако, характеризующее вероятность нахождения электрона в трехмерном пространстве вокруг ядра.
Область пространства вокруг ядра, в которой нахождение электрона наиболее вероятно, называется орбиталью.
В пределах орбитали заключается ~ 90 % электронного облака. Орбитали имеют различные размеры и форму. Если электрон находится на орбитали меньшего размера, то он сильнее притягивается ядром, чем электрон, занимающий орбиталь большего размера.
Энергия электрона имеет целочисленное значение и может изменяться лишь целыми, точно определенными порциями - квантами энергии.
Энергетическое состояние электрона в атоме характеризуется
четырьмя квантовыми числами: главным, орбитальным, магнитными
спиновым.
Главное квантовое число n связано с номером энергетического уровня, характеризует общую энергию электрона на данном уровне и его удаленность от ядра.
Главное квантовое число принимает значения от 1 до ∞. Для известных химических элементов, когда атомы находятся в невозбужденном состоянии, главное квантовое число может принимать положительные целочисленные значения от 1 до 7.
Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n = 1). С увеличением n энергия электрона и его удаленность от ядра возрастают.
|
|
|
Число заполняемых энергетических уровней в атоме численно равно номеру периода, в котором находится элемент.
Так, все электроны элементов I периода имеют один энергетический уровень с главным квантовым числом равным единице (n = 1). У атомов элементов II периода главное квантовое число равно двум (n = 2) и т.д.
Максимальное число электронов на данном энергетическом уровне определяется уравнением:
N = 2 n 2,
где N - число электронов на данном энергетическом уровне, n - номер уровня (номер периода, главное квантовое число).
Следовательно, на первом энергетическом уровне может находиться не более 2 электронов, на втором не более 8, на третьем – не более 18, на четвертом - не более 32.
Энергетические уровни обозначают буквами.
Числовое значение уровня n 1 2 3 4 5 6 7
Буквенное обозначение K L M N O P Q.
Орбитальное (побочное) квантовое число l характеризует различное энергетическое состояние электронов, находящихся на конкретном энергетическом уровне.
Орбитальное (побочное) квантовое число определяет форму электронного облака, т.е. пространственную область наиболее вероятного нахождения электрона. Значение орбитального квантового числа l зависит от значения главного квантового числа n. Оно принимает значения 0, 1, 2, 3… (n –1), т.е. от 0 до (n –1).
Совокупность электронов, характеризующихся одинаковым значением орбитального квантового числа l, называется энергетическим подуровнем. Подуровни обозначают буквами:
Значение орбитального квантового числа l 0 1 2 3
Обозначение энергетического подуровня s p d f.
Каждому значению l соответствует определенный энергетический подуровень и определенная форма орбитали. Количество таких подуровней совпадает с номером уровня или со значением главного квантового числа n.
|
|
|
Таким образом, при l = 0, 1, 2, 3 электроны находятся соответственно на s -, p -, d -, f -подуровнях. При данном значении главного квантового числа n наименьшую энергию имеют электроны s-подуровня, затем p -, d -, f -подуровней. Электроны различных подуровней называют s -, p -, d -, f -электронами или электронами, находящимися на s-, p -, d -, f -атомных орбиталях.
Число энергетических подуровней в уровне не должно быть больше главного квантового число n. Так, первый уровень (n = 1) имеет один подуровень (s), второй уровень (n = 2) – два подуровня (s и p), третий (n = 3) – три (s, p, d), четвертый (n = 4) – четыре (s, p, d, f). В оболочках атомов ныне известных элементов электроны застраивают на каждом уровне не более четырех подуровней.
При l = 0 (s – подуровень) электронное облако имеет сферическую форму.



Рис. 4.2. Форма s -орбитали
При l = 1 (р – подуровень) орбиталь имеет форму гантели.
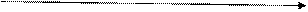

Рис. 4.3. Форма p -орбитали
Рисунки орбиталей с сайта http://w.w.w.hybridation.ru/site/htm
Орбитали d и f имеют более сложную форму (см. рис. 4.5.).
Магнитное квантовое число m характризует пространственную ориентацию орбиталей данного подуровня относительно внешнего магнитного поля.
Магнитное квантовое число m может принимать значения любых целых чисел от –l до +l включая 0, т.е. всего 2 l + 1 значение. Таким образом, (2 l + 1) – число энергетических состояний (атомных орбиталей), на которых могут находиться электроны данного подуровня.
Например, для s -подуровня l = 0 и потому m имеет единственное значение: m = 0. Таким образом, на s -подуровне имеется единственная s-орбиталь, которая имеет форму сферы, расположенной симметрично относительно ядра атома.
р-орбиталь («гантель») в магнитном поле может ориентироваться в пространстве в трех различных положениях, т.е. при l = 1, может принимать три значения: +1, 0, –1. Поэтому p – атомные орбитали ориентированы в пространстве по трем координатным осям (х, у, z).
Соответственно, р -орбитали обозначаются рх, ру и рz. (рис. 4.4).
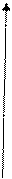 |





py px pz
Рис. 4.4. Ориентация в пространстве px, py и pz орбиталей
d-подуровень (l = 2) имеет пять значений магнитного квантового числа m: –2, –1, 0, 1, 2 и, следовательно, пять d -орбиталей, которые ориентированы по пяти разным направлениям.
|
|
|






Рис. 4.5. Возможные формы d -орбиталей
f-подуровень (l = 3) имеет семь значений магнитного квантового числа (ml: –3, –2, –1, 0, 1, 2, 3,) т.е. семь различных f -орбиталей. Число ориентаций f -орбиталей равно семи.
 Условно атомные орбитали (АО) обозначают в виде квадрата (квантовой ячейки)
Условно атомные орбитали (АО) обозначают в виде квадрата (квантовой ячейки)
 Соответственно, для s -подуровня имеется одна АО
Соответственно, для s -подуровня имеется одна АО
 для p ‑подуровня – три АО
для p ‑подуровня – три АО
 для d -подуровня – пять АО,
для d -подуровня – пять АО,
 |
для f ‑подуровня – семь АО
Таким образом, электроны в атоме располагаются по энергетическим уровням, удаленность этих уровней от ядра характеризуется значением главного квантового числа n. Энергетические уровни состоят из подуровней, число подуровней для каждого уровня не превышает значение n. Подуровни, в свою очередь, состоят из орбиталей, форма которых определяется значением орбитального квантового числа l, а количество задается числом значений магнитного квантового числа m.
Если рассматривать электрон как частицу, то кроме движения вокруг ядра, он вращается вокруг собственной оси. Это движение получило название «спин».
Спиновое квантовое число msхарактеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против).
Спиновое квантовое число ms принимает два значения:
ms = +1/2 и ms = –1/2.
Электроны, характеризующиеся спиновым квантовым числом
ms = +1/2, принято обозначать стрелкой, направленной вверх:

Электроны, характеризующиеся спиновым квантовым числом
ms = –1/2, обозначают стрелкой, направленной вниз:
 |
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 616; Нарушение авторских прав?; Мы поможем в написании вашей работы!