
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атом Бора
|
|
|
|
Основные формулы:
Первый постулат Бора: электроны в атоме могут двигаться только по определенным орбитам, находясь на которых они не излучают энергии. Эти орбиты называются стационарными и определяются условием
m υ nrn = n ћ, (1.1)
где rn – радиус n -ой орбиты, υ n – скорость электрона на этой орбите; m υ nrn – момент импульса электрона, n – главное квантовое число (n =1, 2, 3…), ћ= 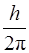 , h – постоянная Планка, равная 6,62·10-34 Дж·с.
, h – постоянная Планка, равная 6,62·10-34 Дж·с.
Второй постулат Бора: при переходе электрона с одной орбиты на другую атом излучает или поглощает квант энергии, равный
h ν= Em - En, (1.2)
где Em и En – энергии электрона на соответствующих орбитах.
Сериальная формула, определяющая длину волны света, излучаемого или поглощаемого атомом водорода при переходе из одного стационарного состояния в другое:
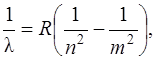 (1.3)
(1.3)
где R – постоянная Ридберга, равная 1,097·107 м-1, n и m – целые числа, называемые квантовыми.
Квантовое число n определяет серию спектральных линий: n =1 – серия Лаймана (ультрафиолетовое излучение), n =2 – серия Бальмера (видимое излучение), n =3 – серия Пашена (первая инфракрасная серия), n =4 – серия Брэкета (вторая инфракрасная серия), n =5 – серия Пфунда (третья инфракрасная серия).
Сериальная формула для длин волн линий спектра водородоподобных ионов (т.е. ионов, имеющих по одному электрону: He+, Li++ и т.д.)
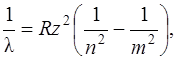 (1.4)
(1.4)
где z – порядковый номер элемента в таблице Менделеева.
Для рентгеновских спектров выполняется закон Мозли, согласно которому положение линий определяется соотношением
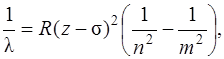 (1.5)
(1.5)
где σ – постоянная экранирования, n =1 соответствует K -серии, n =2 соответствует L -серии, n =3 соответствует M -серии Для K -серии σ=1.
Коротковолновая граница λmin сплошного рентгеновского спектра определяется формулой
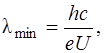 (1.6)
(1.6)
где e – заряд электрона, U – напряжение в рентгеновской трубке.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1040; Нарушение авторских прав?; Мы поможем в написании вашей работы!