
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ІІ блок «Теоретичні питання з тириметричного та фізико-хімічних методів аналізу». 1 страница
 |
1. Загальна характеристика титриметричного аналізу. Класифікація методів.
2. Вимоги до реакцій, що використовують у титриметричному аналізі.
3. Способи представлення концетрацій розчинів у титриметрії, обчислення еквівалентних мас у різних методах титриметричного аналізу. Закон еквівалентів, використання закону у титриметричних методах аналізу.
4. Титрування. Точка еквівалентності.
5. Стандарти та робочі розчини у титриметрії. Первинні і вторинні стандарти. Фіксанали.
6. Вимоги, що ставляться до первинних стандартів.
7. Способи титрування: пряме титрування; зворотне титрування; титрування замісника. Навести приклади.
8. Спосіб титрування методом окремих наважок та піпетування. Обчислення результатів аналізу у титриметричних методах.
9. Написати формули для розрахунку результатів прямого титрування, якщо концентрація робочого розчину виражена в одиницях: а) молярної концентрації еквівалента; б) титра; в) титра за визначуваною речовиною.
10. Криві титрування. З якою метою будують криві титрування? Стрибок титрування та точка еквівалентності.
11. Встановлення точки еквівалентності в титриметрії. Яка різниця між точкою еквівалентності і точкою кінця титрування?
12. Метод кислотно-основного титрування. Дайте його коротку характеристику.
13. Стандартні розчини, які використовують у методах кислотно-основного титрування. Первинні та вторинні стандарти методу.
14. Точка еквівалентності при титруванні кислот і основ. Побудова кривих титрування сильних, слабих кислот і основ.
15. Індикатори в методах кислотно-основного титрування. Вимоги до них.
16. Іонна та іонно-хромофорна теорія індикаторів.
17. Показник титрування та інтервал переходу забарвлення рН-індикатора.
|
|
|
18. Принцип вибору індикатора в кислотно-основному титруванні для встановлення кінцевої точки титрування.
19. Похибки протолітометричного титрування.
20. Види індикаторних похибок: гідроксонієва, гідроксидна.
21. Види індикаторних похибок: кислотна, основна.
22. Протолітометричне титрування в неводних середовищах.
23. Приклади визначення різних протолітів методами кислотно-основного титрування: сильні кислоти та сильні основи.
24. Приклади визначення різних протолітів методами кислотно-основного титрування: слабкі кислоти та слабкі основи.
25. Приклади визначення різних протолітів методами кислотно-основного титрування: амфоліти; солі.
26. Практичне застосування методу кислотно-основного титрування. Визначення тимчасової твердості води.
27. Метод окисно-відновного титрування.
28. Вимоги до окисно-відновних реакцій в редоксиметрії.
29. Класифікація методів окисно-відновного титрування.
30. Рівняння Нернста. Вплив різних чинників на величину редокс потенціалу.
31. Обчислення в методі редоксиметрії. Особливості визначення молярної маси еквівалента в окисно-відновних реакціях.
32. Криві титрування в методі редоксиметрії.
33. Індикатори методів редоксиметрії. Вимоги до них.
34. Принцип методу перманганатометрії.
35. Робочі розчини в перманганатометрії. Первинні стандарти методу, стандартизація розчинів калій перманганату.
36. Правила зберігання стандартного розчину KMnO4. Причини зміни концентрація KMnO4 при зберіганні.
37. Перманганатометричне визначення феруму.
38. Перманганатометричне визначення мангану (ІІ).
39. Перманганатометричне визначення нітритів.
40. Йодометрія. Первинні стандарти і робочі розчини в йодометрії. Особливості фіксації точки еквівалентності в йодометрії
41. Йодометричне визначення арсенітів.
42. Йодометричне визначення купруму.
43. Біхроматометрія (суть методу, титрант, індикатор, особливості визначення).
|
|
|
44. Броматометрія (робочі розчини, фіксування точки еквівалентності).
45. Використання комплексних сполук в аналізі.
46. Методи комплексонометричного титрування, принцип методів.
47. Криві титрування в комплексонометрії. Стрибок титрування. Які фактори впливають на його величину?
48. Металохромні індикатори в комплексонометрії.
49. Комплексонометричне визначення загальної твердості води.
50. Комплексонометричне визначення кальцію та магнію у сумісній присутності.
51. Комплексонометричне визначення алюмінію.
52. Комплексонометричне визначення феруму(ІІІ).
53. Загальна характеристика методів осадження. Вимоги до реакцій, які використовують у методах осадження.
54. Побудова кривих титрування в методі осадження.
55. Вплив розчинності сполук, концентрації реагентів і температури на характер кривих титрування методу осадження.
56. Фіксація точки еквівалентності в методах осадження. Застосування адсорбційних та специфічних індикаторів.
57. Аргентометрія: метод Мора.
58. Аргентометрія: метод Фаянса.
59. Аргентометрія: метод Фольгарда.
60. Меркурометрія (робочі розчини, фіксування точки еквівалентності).
61. Спектрофотометричний аналіз. Основні величини, що характеризують поглинання світла речовиною.
62. Спектр електромагнітного випромінювання, основні його характеристики (довжина хвилі, частота, хвильове число).
63. Основний закон світлопоглинання – закон Бугера-Ламберта-Бера його математичний і графічний вираз.
64. Причини відхилення від основного закону світлопоглинання.
65. Молярний коефіцієнт світлопоглинання, істинне та ефективне його значення.
66. Основні типи забарвлених сполук, які використовують у фотометричному методі аналізу.
67. Чинники, які впливають на вихід забарвленого продукту у спектрофотометричному аналізі.
68. Способи визначення концентрації речовини у спектрофотометрії. Дати коротку характеристику кожному із них.
69. Методи диференційної фотометрії.
70. Екстракційно-фотометричні методи аналізу.
71. Селектори та детектори у спектрофотометрах, їх призначення.
72. Визначення феруму фотометричним методом.
73. Полуменева фотометрія, теоретичні основи методу.
74. Види полуменевої фотометрії: атомно-адсорбційний та атомно-емісійний аналіз.
|
|
|
75. Полум’я та його характеристика.
76. Фізико-хімічні процеси в полум’ї.
77. Класифікація і загальна характеристика електрохімічних методів аналізу.
78. Потенціометрія. Теоретичні основи методу. Рівняння Нернста.
79. Пряма потенціометрія. Залежність електродного потенціалу від концентрації іону в розчині. Іонометрія.
80. Потенціометричне титрування. Його переваги над класичними титриметричними методами.
81. Класифікація і характеристика електродів.
82. Індикаторні електроди і електроди порівняння.
83. Електроди І-го і ІІ -го роду. Навести приклади.
84. Скляний електрод. Його будова та призначення. Можливості використання в хімічному аналізі.
85. Потенціометричне визначення рН.
86. Вольтамперометрія. Теоретичні основи.
87. Класична полярографія, рівняння Ільковича.
88. Ртутний крапельний електрод. Недоліки і переваги ртутного крапельного електрода над твердими електродами.
89. Вольтамперна крива та умови її одержання.
90. Рівняння полярографічної хвилі, графічна обробка полярографічної хвилі. Потенціал півхвилі, потенціал розкладу.
91. Дифузійний, міграційний та залишковий струми. Граничний дифузійний струм.
92. Роль фонового електроліту при полярографічному визначенні речовин. Вимоги до фонового електроліту.
93. Максимуми І та ІІ роду на поляризаційній криві. Способи їх усунення.
94. Якісний та кількісний полярографічний аналіз.
95. Кулонометрія. Закон Фарадея.
96. Кулонометричне титрування.
97. Електрогравіметрія.
98. Пряма кондуктометрія.
99. Кондуктометричне титрування.
100. Методи розділення та концентрування.
101. Екстракційні методи розділення та концентрування.
102. Константа розподілу, ступінь екстракції, фактор розділення, коефіцієнт концентрування.
103. Хроматографія, основні принципи методу.
104. Види хроматографії (іонообмінна, рідинна, розподільча, газорідинна).
105. Іонообмінна хроматографія.
106. Тонкошарова хроматографія.
107. Застосування хроматографічних методів у аналізі.
ІІІ блок «Якісний аналіз.»
1. Класифікація катіонів за аміачно-фосфатним методом. Поняття про групові реагенти. Навести приклад реакції з груповим реагентом.
|
|
|
2. Назвати груповий реактив на ІІ аналітичну групу катіонів і покажіть його дію на прикладі іону Са2+ (аміачно-фосфатна класифікація).
3. Назвати груповий реактив на ІІІ аналітичну групу катіонів і покажіть його дію на прикладі іону Сu2+ (аміачно-фосфатна класифікація).
4. Назвати груповий реактив на V аналітичну групу катіонів і покажіть його дію на прикладі одного із катіонів (аміачно-фосфатна класифікація).
5. Якісний аналіз аніонів. Поділ аніонів на групи. Навести групові реагенти на відповідні групи аніонів.
6. Характерні реакції на катіони першої групи згідно з аміачно-фосфатною класифікацією.
7. Характерні реакції на аніони Cl-, SО42-, NО3-.
8. Наведіть схему аналізу суміші катіонів ІІ-ї групи.
9. Аналіз суміші двохзарядних катіонів ІІ-ї аналітичної групи.
10. Реакції з груповим реагентом та характерні реакції на аніони першої групи СО32-, SО42-, PО43-.
11. Назвати групові реагенти на кожну групу аніонів у якісному аналізі та навести приклади відповідних реакцій
12. Характерні реакції на катіони NH4+, Ca2+, Ba2+.
13. Характерні реакції на катіони Nа+, Fe2+, Cа2+.
14. Характерні реакції на іони SО42-, Mn2+, NО3-.
15. Характерні реакції на катіони Na+, Mn2+, Cu2+.
16. Характерні реакції на катіони Mn2+, Ag+, Pb2+.
17. Характерні реакції на іони Nа+, Fe2+, PО43-.
18. Характерні реакції на катіони К+, Ca2+, Ba2+.
19. Характерні реакції на іони SО42-, Mn2+, Cl-.
20. Характерні реакції на іони Cu2+, Pb2+, SО42-.
21. Характерні реакції на аніони PО43-, Cl-, NО3-.
22. Характерні реакції на іони Fe2+, Ag+, СО32-.
23. Характерні реакції на катіони K+, Fe3+, Mn2+.
24. Характерні реакції на іони Cа2+, Pb2+, РО43-.
25. Характерні реакції на катіони NH4+, Fe3+, Cu2+.
26. Характерні реакції на катіони К+, Fe2+, Cа2+.
27. Характерні реакції на катіони Nа+, Fe3+, Ba2+.
28. Аналіз суміші іонів К+, Мg2+, Al3+, Ba2+.
29. Складіть схему аналізу суміші іонів: NH 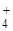 , Fe3+, K+, Ba2+.
, Fe3+, K+, Ba2+.
30. Аналіз суміші іонів К+, Мg2+, Al3+, Ba2+.
31. Складіть схему аналізу суміші таких іонів: NH 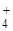 , Fe3+, K+, Ba2+.
, Fe3+, K+, Ba2+.
32. Аналіз суміші катіонів Na+, Mn2+, Ca2+, Al3+.
33. Аналіз суміші іонів NH 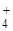 , K+, Fe3+, Mg2+, Cr3+.
, K+, Fe3+, Mg2+, Cr3+.
34. Аналіз суміші іонів Na+, K+, Fe2+, Ва2+.
35. Складіть схеми аналізу суміші катіонів NH 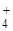 , K+, Fe3+, Mg2+.
, K+, Fe3+, Mg2+.
36. Складіть схему аналізу суміші катіонів: Ca2+, Cr3+, Al3+, Mn2+.
37. Складіть схему аналізу суміші таких іонів: Na+ NH  , Mn2+.
, Mn2+.
38. Складіть схему аналізу суміші таких катіонів: Ag+, Ca2+, Zn2+.
39. Складіть схему аналізу катіонів: Na+, Mn2+, Ca2+, Cr3+.
40. Складіть схему аналізу такої суміші іонів: K+, Ba2+, Mg2+, Fe3+.
41. Складіть схему аналізу катіонів: NH  , Ca2+, Mn2+, Al3+.
, Ca2+, Mn2+, Al3+.
42. Складіть схему аналізу катіонів: K+, Ba2+, Mg2+, Fe3+.
43. Складіть схему аналізу суміші іонів: NH  , Ca2+, Mn2+, Fe3+.
, Ca2+, Mn2+, Fe3+.
44. Складіть схему аналізу катіонів: Na+, Ba2+, Mg2+, Fe3+.
45. Складіть схему аналізу катіонів Cr3+, Al3+, Fe3+.
46. Складіть схему аналізу катіонів K+, Ca2+, Mn2+, Fe2+.
47. Написати в молекулярному і в іонному вигляді рівняння:
a) розчинення барій фосфату в етановій кислоті;
б) окиснення хром(ІІІ) сульфату гідроген пероксидом у лужному середовищі;
48. Написати в молекулярному і в іонному вигляді рівняння:
а) розчинення алюміній фосфату в надлишку натрій гідроксиду;
б) окислення манган(ІІ) нітрату натрій бісмутатом;
49. Написати в молекулярному і в іонному вигляді рівняння:
а) розчинення кальцій фосфату в кислотах;
б) окиснення хром(ІІI) сульфату калій перманганатом у середовищі сульфатної кислоти;
50. Написати в молекулярному і в іонному вигляді рівняння:
а) розчинення ферум(ІІІ) фосфату в кислотах;
б) окислення манган(ІІ) сульфату амоній пероксидисульфатом у середовищі сульфатної кислоти;
ІV блок «Практичні завдання та задачі з гомогенної рівноваги.»
1. Написати рівняння протолізу гідрогенсульфіт-іону в водному розчині.
2. Написати рівняння протолізу гідрогеноксалат-іону в водному розчині.
3. Написати рівняння протолізу оксалат-іону в водному розчині.
4. Написати рівняння протолізу оксалатної кислоти у водному розчині.
5. Написати рівняння протолізу фосфат-іону у водному розчині.
6. Написати рівняння протолізу гідрогенсульфід-іону в водному розчині.
7. Написати рівняння протолізу форміатної (метанової) кислоти у водному розчині.
8. Написати рівняння протолізу ортофосфатної кислоти у водному розчині.
9. Написати рівняння протолізу гідрогенсульфат-іону у водному розчині.
10. Написати рівняння протолізу гідрогенфосфат-іону у водному розчині.
11. Написати рівняння протолізу дигідрогенфосфат-іону у водному розчині.
12. Написати рівняння протолізу сульфіт-іону у водному розчині.
13. Написати рівняння протолізу сульфід-іону у водному розчині.
14. Написати рівняння протолізу етанової (ацетатної) кислоти у водному розчині.
15. Написати рівняння протолізу карбонатної кислоти у водному розчині.
16. Написати рівняння протолізу етанат-іону у водному розчині.
17. Написати рівняння протолізу гідрогенкарбонат-іону в водному розчині.
18. Написати рівняння протолізу карбонат-іону в водному розчині.
19. Написати рівняння протолізу метанат-іону у водному розчині.
20. Які речовини у водному розчині є кислотами, а які основами згідно теорії Бренстеда-Лоурі: NH4+, НСО3-, S2-, HCOO-, НС2О4-, HSО3-, HPO42-? Написати відповідні рівняння реакції протолізу.
21. Вплив неводних середовищ на кислотні і основні властивості протолітів. Проілюструвати на прикладах.
22. Які речовини у водному розчині є кислотами, а які основами згідно теорії Бренстеда-Лоурі: NH3, СО32-, S2-, CH3COO-, НСО3-, HS-, H2PO4-? Написати відповідні рівняння реакції протолізу.
23. Які речовини у водному розчині є кислотами, а які основами згідно теорії Бренстеда-Лоурі: Н2СО3, HS-, NH4+, H2O, H2S? Написати відповідні рівняння реакції.
24. Написати реакцію протолізу ацетатної кислоти в аміаці.
25. Написати реакцію протолізу сульфатної кислоти в середовищі льодяної ацетатної кислоти.
26. Розрахувати іонну силу розчину при розчиненні 0,01 моль Nа2SО4, та 0,02 моль FeCl3 в 250 мл води.
27. Розрахувати іонну силу розчину при розчиненні по 0,01 моль CuCl2 та Na2SO4 в 500 мл води.
28. Розрахувати іонну силу 0,02 М розчину MnCl2.
29. Розрахувати іонну силу розчину при розчиненні 0,02 моль ВаCl2, та 0,02 моль АlCl3 в 200 мл води.
30. Розрахувати іонну силу розчину при розчиненні 0,2 моль ВaCl2 та 0,05 моль АlCl3 в 250 мл води.
31. Розрахувати іонну силу розчину при розчиненні 0,02 моль FeCl3 та 0,1 моль Na2SO4 в 250 мл води.
32. Розрахувати іонну силу розчину при розчиненні 0,1 моль CaCl2 та 0,25 моль NaCl в 200 мл води.
33. Розрахувати іонну силу 0,1 М водного розчину АlCl3.
34. Розрахувати іонну силу розчину при розчиненні 0,01 моль FeCl3 та 0,03 моль Na2SO4 в 500 мл води.
35. Розрахувати іонну силу розчину, який містить 0,1 моль К2SO4 та 0,05 моль МnCl2 в 250 мл розчину.
36. Розрахувати коефіцієнти активності Al3+ та Cl- -іонів у розчині з йонною силою 0,018.
37. Розрахувати коефіцієнти активності Fe3+ та SO42- -іонів у розчині з йонною силою 0,18.
38. Розрахувати коефіцієнти активності Al3+ та Cl- -іонів у розчині з йонною силою 0,17.
39. Розрахувати коефіцієнти активності Ca2+ та Cl- -іонів у розчині з йонною силою 0,01.
40. Розрахувати коефіцієнти активності NH4+ та PO43- -іонів у розчині з йонною силою 0,14.
41. Розрахувати коефіцієнти активності Na+ та NO3- -іонів у розчині з йонною силою 0,015.
42. Розрахувати коефіцієнти активності Cr3+ та SO42 -іонів у розчині з йонною силою 0,008.
43. Розрахувати коефіцієнти активності K+ та CO32- -іонів у розчині з йонною силою 0,017.
44. Розрахувати коефіцієнти активності NH4+ та NO3- -іонів у розчині з йонною силою 0,12.
45. Розрахувати коефіцієнти активності Ba2+ та Cl- -іонів у розчині з йонною силою 1,0.
46. Розрахувати активність іонів Nа+ і SО42- в 0,1 М розчині Nа2SО4, якщо γ (Na+) = 0,31, а γ (SO42-)=0,42.
47. Розрахувати активність іонів гідроксонію в 0,01 М розчині нітратної кислоти, якщо γ (H3О+) = 0,82. Яке рН цього розчину?
48. Розрахувати активність іонів Са2+ і Cl- в 0,02 М розчині СаCl2, якщо γ (Са2+) = 0,42, а γ (Cl) = 0,81.
49. Розрахувати активність іону К+ та SО42- в 0,1 М розчині К2SO4, якщо γ(K+) = 0,81, а γ(SO42-) = 0,42.
50. Розрахувати активність іонів Nа+ і SО42- в 0,02 М розчині Nа2SО4, якщо γ(Na+) = 0,31, а γ(SO42-) = 0,42.
51. Розрахувати активність іонів Са2+ і Cl- в 0,1 М розчині СаCl2, якщо γ(Ca2+) = 0,42, а γ(Cl-) = 0,84.
52. Розрахувати активність іонів гідроксиду в 0,11 М розчині натрій гідроксиду, якщо
γ (ОH-) = 0,71. Яке рН цього розчину?
53. Розрахувати активність іонів гідроксонію в 0,013 М розчині хлоридної кислоти, якщо γ (H3О+) = 0,64. Яке рН цього розчину?
54. Розрахувати активність іонів Сu2+ і SО42- в 0,14 М розчині СuSО4, якщо γ (Сu2+) = 0,42, а γ (SО42-) = 0,37.
55. Розрахувати активність іону Fe3+ та NO3- в 0,17 М розчині Fe(NO3)3, якщо γ(Fe3+) = 0,84, а γ(NO3-)= 0,40.
56. Розрахувати рН 0,2 М розчину ацетатної (етанової) кислоти (pKа (CH3COOH)=4,76).
57. Розрахувати рН 0,02 М розчину амоній хлориду (pKb (NH3) = 4,75).
58. Розрахувати рН 0,02 М розчину натрій етанату (pKa (CH3COOH) = 4,75).
59. Розрахувати рН 0,5 М розчину форміатної (метанової) кислоти (pKa (CHOOH) = 3,75).
60. Розрахувати рН розчину, який містить 0,01 моль NН3 та 0,01 моль NН4Cl в 200 мл розчину (pKb (NH3) = 4,75).
61. Розрахувати рН розчину, який містить 0,1 моль етанової кислоти та 0,1 М розчин натрій етанату (pKa (CH3COOH) = 4,75).
62. Розрахувати рН 0,05 М розчину амоніаку (pKb (NH3) = 4,75).
63. Розрахувати рН 0,01 М розчину натрій гідроксиду.
64. Розрахувати рН 0,01 М розчину хлоридної кислоти.
65. Розрахувати рН 0,01 М розчину сульфатної кислоти.
66. Як зміниться константа протолізу амоніаку, якщо в 1 л його розчину розчинили 6 г натрій хлориду?
67. Як зміниться константа протолізу ацетатної кислоти в присутність 0,01М розчину калій нітрату?
68. Як зміниться константа протолізу метанової кислоти у присутністі 0,03 М розчину кальцій хлориду?
69. Як зміниться константа протолізу CH3NH2, якщо до 100,0 мл його водного розчину додати 1,1 г кальцій хлориду?.
70. Розрахувати 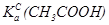 при іонній силі 0,04.
при іонній силі 0,04.
71. Навести значення 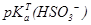 і
і 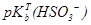 .
.
72. Навести значення  і
і  .
.
73. Навести значення  та
та 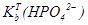 .
.
74. Навести значення КТa, рКТa, рКТb, і КТb для іона H2PO4–.
75. Навести значення КТа, рКТа, рКТb, і КТb для іона HS–.
76. Розрахвати рН і ступінь протолізу амоніаку в розчині, одержаному при 100-кратному розбавленні водою 10 мл 30,0 % розчину амоніаку (r = 0,892 г/мл).
77. Скільки мг NaOH міститься в 250 мл розчину з рН 12,0?
78. До 20 мл 30,0 % розчину нітратної кислоти (r = 1,185 г/мл) додали дистильовану воду до загального об¢єму 400 мл. Розрахувати рН одержаного розчину.
79. Скільки мг CH3COOH міститься в 100,0 мл розчину з рН 3,0?
80. Обчисліть рН розчину, в 200 мл якого міститься 0,252 г НNO3.
81. Скільки г КОН потрібно розчинити у 500 мл дистильованої води, щоб одержати розчин з рН 11,0?
82. Для водного розчину нітратної кислоти рН дорівнює 2,0. Обчисліть масу кислоти (г) у 250 мл такого розчину.
83. Скільки (г) форміатної (метанової) кислоти міститься у 500 мл її розчину, рН якого 3,0?
84. До 50 мл 3,37 % розчину HCl (r = 1,015 г/мл) додано 150 мл води. Обчисліть рН одержаного розчину.
85. Обчисліть рН і ступінь протолізу етанової кислоти в 5,0·10-3 M її розчину.
86. У 300 мл розчину міститься 0,282 г нітритної кислоти. Обчисліть рН розчину і ступінь протолізу кислоти у цьому розчині.
87. Стократно розвели дистильованою водою 20,0 % розчин нітратної кислоти (r = 1,115 г/мл). Обчисліть рН одержаного розчину.
88. У 200 мл розчину міститься 0,03 г H2SO4. Обчисліть рН цього розчину.
89. До 250 мл 0,2 М розчину нітритної кислоти додали 4,5 г калій нітрату. Як зміниться ступінь протолізу нітритної кислоти?
90. Стократно розвели водою 10,0 мл 8,82 % розчину NH3 (r = 0,962 г/мл). Розрахувати рН і ступінь протолізу NH3 в такому розчині.
91. Розвели водою до об¢єму 500 мл 5,0 мл 36,2% розчину CH3COOH (r = 1,045 г/мл). Розрахувати рН розчину і ступінь протолізу кислоти в цьому розчині після розведення.
92. Обчислити активність іона гідроксонію у 0,01 М розчині хлоридної кислоти в присутності 0,06 М розчину Ca(NO3)2.
93. Як зміниться ступінь протолізу CH3COOH якщо у 200 мл 0,1 М розчину розчинити 5,0 г Na2SO4?
94. Розрахувати ступінь протолізу 0,2 М розчину амоніаку у 200,0 мл якого розчинили 3,0 г натрій хлориду.
95. Розрахувати [Н+] і рН розчину, одержаного змішуванням однакових об¢ємів 3,3 % розчину NaOH (r = 1,035 г/мл) і 0,1 М HCl.
96. Як зміниться рН 0,05 М розчину HCl при додаванні натрій сульфату до кінцевої концентрації 0,5 М?
97. Визначіть [Н+] і рН розчину одержаного змішуванням розчинів 0,01 М НСl і 0,01 М NaOH в об¢ємному співвідношенні відповідно 2:1.
98. Обчислити рівноважну концентрацію і активність іонів CH3COO- в 0,1 М розчині етанової кислоти в присутності 0.05 М розчину KCl.
99. Як зміниться константа протолізу амоніаку, якщо в 1 л його розчину розчинили 6 г натрій хлориду?
100.Як зміниться константа протолізу амоніаку присутність 0,01 М розчину калій нітрату?
101.Як зміниться константа протолізу метанової кислоти у присутністі 0,01 М розчину кальцій хлориду?
102.Як зміниться константа протолізу CH3NH2, якщо до 100,0 мл його водного розчину додати 1,1 г кальцій хлориду?.
103.Обчислити рН розчину, що містить СН3СООН і НCl, якщо концентрації цих речовин дорівнюють 0,02 М і 0,1 М відповідно.
104.Розрахувати рН 0,05 М розчину амоній нітрату
105.Розрахувати  при pH = 6,0.
при pH = 6,0.
106.До 50 мл 0,05 М розчину хлоридної кислоти додано 30 мл 0,1 М розчину натрій гідроксиду. Обчисліть рН і [ОН-] в одержаному після змішування розчині.
107.До 500 мл 0,1 М NH3 додали 100 мл 0,3 М HCl. Розрахувати рН і буферну ємність одержаного розчину.
108.Яку масу NaOH (в г) потрібно додати до 100 мл буферного розчину з рН 4,76, для якого загальна (сумарна) концентрація CH3COOH і CH3COONa становить 0,1 М, якщо необхідно на 1 одиницю збільшити рН такого розчину?
109.Визначити рівноважну концентрацію гідросульфід-іона в розчині Na2S при рН 4, якщо в 200 мл його міститься 1,4 г Na2S.
110.Розрахувати співвідношення молярних концентрацій кислоти і спряженої з нею основи в амонійному буферному розчині з рН 9,0.
111.Змішали 100 мл 0,05 М розчину CH3COOH і 80 мл 0,06 М розчину CH3COONa. Розрахувати рН і буферну ємність одержаного розчину.
112.Змішали 100 мл 0,1 М розчину амоніаку і 50 мл 0,15 М розчину амоній хлориду. Обчислити рН одержанного буферного розчину і його буферну ємність.
113.Змішали 150 мл 0,2 М розчину Na2HPO4 і 250 мл 0,16 М NaH2PO4. Обчислити рН і буферну ємність одержаного розчину.
114.Буферний розчин одержано змішуванням 200 мл 0,04 М розчину НСООН і 50 мл 0,08 М КОН. Обчислити рН цього розчину.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 1372; Нарушение авторских прав?; Мы поможем в написании вашей работы!