
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гольдшмидт, Ферсман
|
|
|
|
Электроотрицательность – величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А – В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А. Получены шкалы (ЭО) для различных валентных состояний атомов, для ионов, молекул и групп атомов (Бацанова и Луо-Бенсона)..
Изоморфная взаимозаместимость (ее пределы при данной температуре) тем меньше, чем больше отличаются электроотрицательности замещающих друг друга атомов (при прочих равных условиях).
Различие электронного строения атомов и разным характером образуемых ими химических связей объясняется отсутствие или ограниченность изоморфизма близких по размерам, но отличающихся по электроотрицательности пар, как К+ и Ag+ Na+ и Сu+ Са2+ и Cd2+
7) Правило полярности (направленности) Гольдшмидта:
а) изовалентное замещение: ион с меньшим радиусом будет входить в общую кристаллическую структуру легче, чем ион с большим радиусом, занимающий ту же позицию. (Na+ охотнее замещает K+ в KCl, чем более крупный K+ будет замещать Na+ в NaCl).
б) гетеровалентное замещение: ион с бóльшим зарядом входит в кристалл легче, чем ион с меньшим зарядом, занимающий ту же кристаллографическую позицию. (Mg2+ может замещаться на Sc3+, а обратное замещение маловероятно (r Mg(2+) = 0.72 Ǻ, r Sc(3+) = 0.75 Ǻ).
в) Ион с меньшим радиусом или бóльшим зарядом входит как примесь в кристаллическую структуру легче, чем ион с бóльшим радиусом или меньшим зарядом (правило полярности Гольдшмидта–Ферсмана).
Н а фоне стремления смешанного кристалла к минимуму электростатической энергии вхождение в структуру иона с меньшим размером или бóльшим зарядом “укрепляет решетку”, т.е. является “энергетически выгодным”.
|
|
|
8) Закон диагоналей Гольдшмидта–Ферсмана
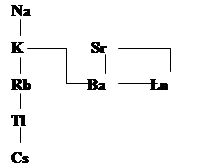 В диагональных направлениях табл увеличение радиуса на 6–10% сопровождается одновременным увеличением заряда. Это обеспечивает наиболее благоприятные условия для гетеровалентного изоморфизма. Диагональные ряды изоморфизма. Стрелки указывают на направленность (полярность) изоморфизма. Иногда направление заменяется на вертикальное, (Zr4+– Hf4+, Nb5+–Ta5+, Mo6+–W6+). Это следствие “лантаноидного сжатия” – уменьшения радиусов Ln-элементов с ростом Z приблизительно на 0.2 Ǻ, в результате которого размеры указанных выше пар атомов оказываются чрезвычайно близки. Так Hf вообще не образует в природе собственных минералов и был обнаружен в рудах циркония.
В диагональных направлениях табл увеличение радиуса на 6–10% сопровождается одновременным увеличением заряда. Это обеспечивает наиболее благоприятные условия для гетеровалентного изоморфизма. Диагональные ряды изоморфизма. Стрелки указывают на направленность (полярность) изоморфизма. Иногда направление заменяется на вертикальное, (Zr4+– Hf4+, Nb5+–Ta5+, Mo6+–W6+). Это следствие “лантаноидного сжатия” – уменьшения радиусов Ln-элементов с ростом Z приблизительно на 0.2 Ǻ, в результате которого размеры указанных выше пар атомов оказываются чрезвычайно близки. Так Hf вообще не образует в природе собственных минералов и был обнаружен в рудах циркония.
«звезды изоморфизма», показывают в обобщенной форме совокупности элементов, связанных с некоторыми элементами изоморфными отношениями. Наиболее тесные изоморфные отношения K обнаруживает со своими ближайшими соседями (Na, Rb, Ba) и менее прочные – с более далекими (Sr, Tl, Cs, Ln).



9) правило кристаллохимической компенсации:
если Ва2+ замещается на Ln3+, то лучшей компенсацией избыточной валентности является одновременное замещение другого иона Ва2+ на К+:
2Ва2+ → Ln3+ + К+
10) Макаров - общий физико-химический критерий возможности изоморфных замещений – принцип индифферентности.
И зоморфные смеси образуются элементами, которые в двойных (металлических) системах не взаимодействуют друг с другом с образованием химических соединений.
|
|
|
|
|
Дата добавления: 2015-05-31; Просмотров: 1294; Нарушение авторских прав?; Мы поможем в написании вашей работы!