
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 1. В баллоне объемом 10 л находится гелий под давлением p1 = 1 МПа и при температуре Т1 = 300 К
|
|
|
|
Пример 1. В баллоне объемом 10 л находится гелий под давлением p1 = 1 МПа и при температуре Т1 = 300 К. После того как из баллона было взято m = 10 г гелия, температура в нем понизилась до T2 = 290 К. Определить давление р2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева–Клапейрона, применив его к конечному состоянию газа:
p2V = 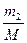 RT2, (1)
RT2, (1)
где m3 – масса гелия в баллоне в конечном состоянии; М – молярная масса гелия; R – молярная газовая постоянная.
Из уравнения (1) выразим искомое давление
p2 = m2RT2/(MV). (2)
Массу т2 гелия выразим через массу т1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона
m2 = m1 - m. (3)
Массу m1 гелия найдем также из уравнения Менделеева – Клапейрона, применив его к начальному состоянию:
m1 = Mp1V/(RT1). (4)
Подставив выражение массы т1 в (3), а затем выражение т2 в (1), найдем
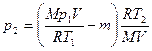 , или
, или  . (5)
. (5)
Проверим, дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых (T2/T1) – безразмерный, а второй – давление. Проверим второе слагаемое:
 .
.
Паскаль является единицей давления. Произведем вычисления по формуле (5), учитывая, что М= 4×10-3 кг/моль:
 = 3,64×105 Па = 0,364 МПа.
= 3,64×105 Па = 0,364 МПа.
Пример 2. Баллон содержит m1 = 80 г кислорода и m2 = 320 г аргона. Давление смеси р= 1 МПа, температура Т = 300 К. Принимая данные газы за идеальные, определить объем V баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Менделеева – Клапейрона, парциальные давления р1 кислорода и р2 аргона выражаются формулами
|
|
|
p1 = m1RT/(M1V), p2 = m2RT/(M2V).
Следовательно, по закону Дальтона, давление смеси газов
p= p1+ p2, или  ,
,
откуда объем баллона
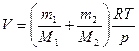 .
.
Произведем вычисления, учитывая, что M1 = 32×10-3 кг/моль,
M2 = 40×10-3 кг/моль (см. табл. А.10 прил. А):
 = 0,0262 м3 = 26,2 л.
= 0,0262 м3 = 26,2 л.
Пример 3 При каком давлении р средняя длина свободного пробега á l ñ молекул азота равна 1 м, если температура газа t ° = 100 °С?
Решение. Давление газа определим как p = nkT, а концентрацию газа определим, используя формулу средней длины свободного пробега молекул 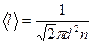 . Откуда
. Откуда  .
.
Произведем вычисления, для чего вычислим температуру азота Т=273+100=373 К, постоянная Больцмана k=1,38×10-23 Дж/К (см. табл. А.1 прил. А). Значение эффективного диаметра d молекулы азота определим, воспользовавшись табл. А.7. прил. А, d =3×10-10 м:
 12, 9×10-3 Па = 12,9 мПа .
12, 9×10-3 Па = 12,9 мПа .
Пример 4. Средняя длина свободного пробега 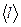 атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.
атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.
Решение. Коэффициент диффузии D определяется формулой
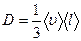 ,
,
где  – средняя арифметическая скорость молекул газа;
– средняя арифметическая скорость молекул газа;
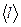 – средняя длина свободного пробега молекул.
– средняя длина свободного пробега молекул.
Средняя арифметическая скорость молекул определяется по формуле
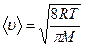 ,
,
где R – молярная газовая постоянная; М – молярная масса газа.
Для нормальных условий Т = 273 К, тогда получим
 .
.
Гелий – газ одноатомный, используя табл. А.10 прил. А, определим молярную массу гелия М = 4×10-3 кг/моль.
Произведем вычисления:
 = 7,23×10-5 м2/c.
= 7,23×10-5 м2/c.
Пример 5. Вычислить удельные теплоемкости при постоянном объеме сV и при постоянном давлении cp неона и водорода, принимая эти газы за идеальные.
Решение. Удельные теплоемкости идеальных газов выражаются формулами
 ,
, 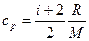 ,
,
где I – число степеней свободы молекулы газа; М – молярная масса. Для неона (одноатомный газ) i = 3 и М = 20×10-3 кг/моль. Произведем вычисления:
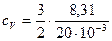 = 2,64×102 Дж/(кг×К);
= 2,64×102 Дж/(кг×К);
 = 1,04×103 Дж/(кг×К).
= 1,04×103 Дж/(кг×К).
Для водорода (двухатомный газ) i = 5 и М = 2×10-3 кг/моль. Тогда  = 1,04×104Дж/(кг×К);
= 1,04×104Дж/(кг×К);
|
|
|
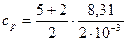 = 1,46×103Дж/(кг×К).
= 1,46×103Дж/(кг×К).
Пример 6. Вычислить удельные теплоемкости cV и cр смеси неона и водорода, если массовые доли неона и водорода составляют
w1 = 80 % и w2 = 20 %. Значения удельных теплоемкостей газов взять из предыдущего примера.
Решение. Удельную теплоемкость сV смеси при постоянном объеме найдем следующим образом. Теплоту, необходимую для нагревания смеси на ΔT, выразим двумя способами:
Q = сV(m1 + m2)ΔT; (2.19)
Q = (сV,1m1+ сV,2m2)ΔT, (2.20)
где cV,1 – удельная теплоемкость неона; cV,2 – удельная теплоемкость водорода.
Приравняв правые части (2.19) и (2.20) и разделив обе части полученного равенства на ΔT, получим cV(m1 + m2) = сV,1m1+ сV,2m2.
Отсюда
 ,
,
или
cV= cV,1w1+ cV,2w2,
где  и
и  .
.
Рассуждая так же, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
cp=cp,1w1+cp,2w2.
Произведем вычисления:
cV = (6,24×102×8 +1,04×104×0,2) = 2,58×103 Дж/(кг×К) =
= 2,58 кДж/(кг×К);
cp = (1,04×103× 0,8+1,46×104×0,2) = 3,75×103Дж/(кг×К)=
= 3,75 кДж/(кг×К).
 Пример 7. Кислород массой m = 2 кг занимает объем V1 = 1м3 и находится под давлением р1 = 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2 = 3 м3, а затем при постоянном объеме до давления р3 = 0,5 МПа. Найти изменение ΔU внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
Пример 7. Кислород массой m = 2 кг занимает объем V1 = 1м3 и находится под давлением р1 = 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2 = 3 м3, а затем при постоянном объеме до давления р3 = 0,5 МПа. Найти изменение ΔU внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
Решение. Построим график процесса в координатных осях p-V.
Так как сначала газ изобарно расширялся, то этому про-цессу соответствует на гра-фике отрезок 1-2 (рис.). Затем газ был изохорно нагрет, что приводит к увели-чению давления; этому про-цессу соответствует на гра-фике отрезок 2-3 (рис. 2.1).
Определение требуемых физических величин можно осуществить двумя вариантами.
Первый вариант. Изменение внутренней энергии газа
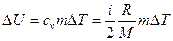 , (1)
, (1)
где i – число степеней свободы молекул газа (для двухатомных молекул кислорода i=5); ΔT = Т3 - Т1 – разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из уравнения Менделеева – Клапейрона pV = 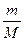 RT, откуда
RT, откуда
 .
.
Работа расширения газа при постоянном давлении выражается формулой
 .
.
Работа газа, нагреваемого при постоянном объеме, равна нулю:
|
|
|
А2 = 0.
Следовательно, полная работа, совершаемая газом:
А = А1 + А2 = А1.
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии ΔU и работы А:
Q = ΔU + А.
Произведем вычисления, учитывая, что для кислорода М = 32×10-3 кг/моль:
 К;
К;
 К;
К;
 К;
К;
 ;
;
A=A1=0,4 МДж;
 ;
;
Q = (3,24 + 0,4) МДж = 3,64 МДж.
Второй вариант. Воспользуемся графиком на рис. 2.1, тогда для участка 1-2 запишем первое начало термодинамики Q1 = Δ U1 + А1.
Для изобарного процесса: А1 = р1 (V2 - V1), Δ U1 = 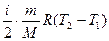 .
.
Воспользуемся уравнением Менделеева-Клапейрона для состояний 1 и 2 (на графике точки 1 и 2 соответственно):
 ; (2)
; (2)
 . (3)
. (3)
Так как р1 = р2, то вычтя из уравнения (3) уравнение (2), получим
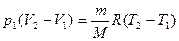 , тогда Δ U1 =
, тогда Δ U1 =  А1, Q1 = А1(
А1, Q1 = А1( + 1).
+ 1).
Для участка 2-3: Q2 = Δ U2 + А2. Этот участок соответствует изохорному процессу, значит А2 = 0, Δ U2 =  .
.
Воспользуемся уравнением Менделеева-Клапейрона для состояния 3 (на графике точка 3):
 . (4)
. (4)
Вычтем из уравнения (4) уравнение (3), получим
 . Из графика видно, что р1 = р2, а V2 = V3,
. Из графика видно, что р1 = р2, а V2 = V3,
откуда 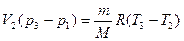 , тогда Δ U2 =
, тогда Δ U2 =  V2(p3 – p1), Q2 = Δ U2.
V2(p3 – p1), Q2 = Δ U2.
Тогда А = А1, Δ U = Δ U1 + Δ U2, Q = Q1 + Q2.
Произведем вычисления:
А = 0,2×106(3 – 1)= 0,4×106 Дж = 0,4 МДж;
Δ U = 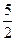 ×0,4×106 +
×0,4×106 + 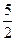 ×3×106(0,5 – 0,2) = 3,25×106 Дж = 3,25 МДж;
×3×106(0,5 – 0,2) = 3,25×106 Дж = 3,25 МДж;
Q = 0,4×106 + 3,25×106 = 3,65×106 Дж = 3,65 МДж.
Пример 8. В цилиндре под поршнем находится водород массой т = 0,02 кг при температуре T1 = 300 К. Водород сначала расширился адиабатно, увеличив свой объем в n1 = 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n2 = 5 раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
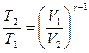 , или
, или 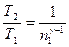 ,
,
где γ – отношение теплоемкостей газа при постоянном давлении и постоянном объеме; n1 = 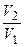 .
.
Отсюда получаем следующее выражение для конечной температуры:
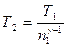 .
.
Работа А1 газа при адиабатном расширении может быть определена по формуле
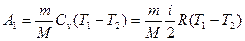 ,
,
где CV – молярная теплоемкость газа при постоянном объеме. Работа A2 газа при изотермическом процессе может быть выражена в виде
|
|
|
 , или
, или  ,
,
где n2 =  .
.
Произведем вычисления, учитывая, что для водорода, как двухатомного газа: γ = 1,4; i = 5 и М = 2×10-3 кг/моль:

 ;
;
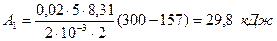 ;
;
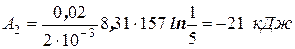 .
.
Знак минус показывает, что при сжатии работа газа совершается над газом внешними силами. График процесса приведен на рис.
Пример 9. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика Т = 500 К. Определить термический КПД η цикла и температуру Т2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу А = 350 Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, превращается в
механическую работу. Термический КПД выражается формулой
 ,
,
где Q1 – теплота, полученная от теплоотдатчика; А – работа, совершенная рабочим телом тепловой машины. Зная КПД цикла, можно по формуле 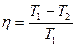 определить температуру охладителя T2:
определить температуру охладителя T2:
T2=T1 (1 - η).
Произведем вычисления:
η = 350/1000 = 0,35; Т2 = 500(1- 0,35) К = 325 К.
Пример 10. Длина волны, на которую приходится максимум энергии в спектре излучения черного тела, λ0 = 0,58 мкм. Определить энергетическую светимость (излучательность) Re поверхности тела.
Решение. Энергетическая светимость Re абсолютно черного тела в соответствии с законом Стефана-Больцмана пропорциональна четвертой степени термодинамической температуры и выражается формулой
Re=σT4, (1)
где σ – постоянная Стефана-Больцмана; Т – термодинамическая температура.
Температуру Т можно вычислить с помощью закона смещения Вина:
λ0 = b / Т, (2)
где b – постоянная закона смещения Вина.
Используя формулы (1) и (2), получаем
 .
.
Произведем вычисления:
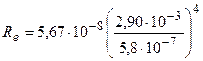 = 3,54·107 Вт/м2 = 35,4 МВт/м2.
= 3,54·107 Вт/м2 = 35,4 МВт/м2.
 Пример 11. В модели абсолютно черного тела (см. рис.) температура стенок полости поддерживается равной 2000 К. Площадь отверстия S = 1 мм2. Определить энергию, излучаемую через отверстие за 1 мин.
Пример 11. В модели абсолютно черного тела (см. рис.) температура стенок полости поддерживается равной 2000 К. Площадь отверстия S = 1 мм2. Определить энергию, излучаемую через отверстие за 1 мин.
Решение. Воспользовавшись законом Стефана-Больцмана, находим искомую величину
Е = R·St = σT4St,
где, по условию, Т = 2000 К, t = 60 с, S = 10-6 м2.
Произведя вычисления, получим ответ: Е = 54,4 Дж.
Пример 12. Максимум излучательной способности поверхности Солнца приходится на длину волны λmax =0,5 мкм.
1) Определить температуру солнечной поверхности, считая, что она по своим свойствам близка к абсолютно черному телу.
2) Найти значение солнечной постоянной – интенсивности солнечного излучения вблизи Земли, за пределами ее атмосферы.
 Решение.
Решение.
1) Температуру солнечной поверхности определим с помощью закона Вина
T = b/ λmax.
Произведя вычисления, получим Т = 5800 К.
2) Значение солнечной постоянной С находим, разделив поток энергии ФE, излучаемый Солнцем по всем направлениям, на площадь поверхности сферы, радиус которой равен среднему расстоянию от Земли до Солнца L = 1,5*1011м(рис. 6.3).
Поток энергии ФE равен произведению энергетической светимости R* Солнца на площадь его поверхности, т.е. ФE =R·4πrc2, где rc ≈ 7*108м – радиус Солнца. Тогда
 .
.
Произведя вычисления, получим ответ:
C = 1400 Дж/(м2с), Т = 5800 К.
Пример 13. Каково значение коэффициента теплопроводности материала стенки, если  и
и  тепловые потери
тепловые потери 
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 5619; Нарушение авторских прав?; Мы поможем в написании вашей работы!