
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йодинол (Iodinolum)
Склад: йоду- 1 г
калію йодиду - 3 г
полівінілового спирту - 9 г
води - до 1 л.
Досліджують йодінол аналогічно 5% спиртовому розчину йоду.
Калію перманганат (Kalii permanganas)
(ДФУ) KMnO4
Отримання. З природного мінералa - пiролюзита:
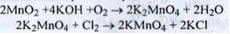
Властивості. Гранульований порошок фіолетового або коричнево -чорного, або темно - фіолетового, або майже чорного кольору. Розчинний у холодній воді. Легко розчинний у киплячій воді.
Ідентифікація.
1. До субстанції додають етанол і розчин натрію гідроксиду розведеного; з'являється зелене забарвлення. Отриманий розчин нагрівають до кипіння; утворюється темно -коричневий осад (ДФУ).
2. Суміш, отриману у випробуванні 1, фільтрують. Отриманий фільтрат дає реакцію (b) на калій (ДФУ):

3. При додаванні до препарату водню пероксиду і кислоти сірчаної розведеної розчин знебарвлюється:

Кількісне визначення.
Йодометрія, замісне титрування (ДФУ). індикатор - крохмаль. (s= 0,2):
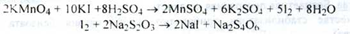
Застосування. Антисептичний засіб.
Зберігання. У добре закупореній тарі.
Лікарські речовини, що містять водню пероксид.
Водню пероксиду розчин 3%
(Hydrogenii peroxidum 3 per centum) (ДФУ)
(Hydrogen peroxide solution)
Водню пероксиду розчин (30%)
(Hydrogenii peroxidum 30 per centum) (ДФУ)
(Hydrogen peroxide solution (30 per centum))
H2O
Отримання. Електроліз 40-68 % розчинів кислоти сірчаної при 5-8 ° С:

При нагріванні розчину у вакумі (50 гПа або 38 мм рт. Ст.) До 70-75 ° С кислота надсірчана розкладається з утворенням водню пероксиду:
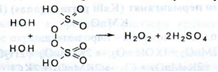
Промислове виробництво водню пероксиду здійснюють шляхом автоокисления повітрям похідних алкілантрагідрохінонів:
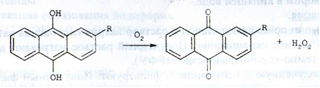
де, R = 2- етил, 2- трет - бутил. 2- пентил;
Процес проводять в суміші бензолу з вторинними спиртами. Водню пероксид екстрагують водою, концентрують перегонкою і ректифікацією. Утворилися алкілантрахінони відновлюють і знову використовують у виробництві.
Фармакопійний препарат містить 2,5-3,5% водню пероксиду.
Властивості. Безбарвна прозора рідина.
(В якості стабілізатора додають 0,05% натрію бензоату або ін речовини).
Ідентифікація.
1. При додаванні до препарату розчину калію перманганату в присутності кислоти сірчаної, спостерігається знебарвлення розчину або розчин стає слабо- рожевим протягом 2 хв. (ДФУ):
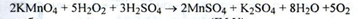
2. Реакція утворення надхромових кислот (ДФУ):
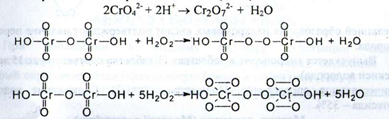
При стоянні синє забарвлення ефірного шару переходить в зелену внаслідок переходу Сг6+ в Сг3+. Діетиловий ефір додають для вилучення надхромових кислот.
3. Розчин повинен витримувати вимоги за кількісним вмістом Н202 (ДФУ)
Випробування на чистоту. У препараті регламентується кислотність, кількість органічних стабілізаторів і сухий залишок.
Кількісне визначення. Перманганатометрія без індикатора, (s = 2,5) (ДФУ):
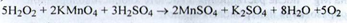
Застосування. Антисептичний засіб.
Зберігання. У захищеному від світла місці; якщо розчин не містить стабілізатор, зберігають при температурі нижче 15 ° С.
(Швидко розкладається при контакті з органічними окислювачами, деякими металами і лугами).
Гідроперит (Нуdroperitum)
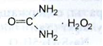
Отримання. При взаємодії еквімолекулярних кількостей сечовини і перекису водню. В якості консерванту додають 0,08 % розчину лимонної кислоти.
Ідентифікація.
1. Сечовину в розчині гідроперита відкривають за допомогою біоуритрової реакції:
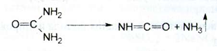
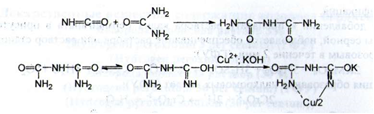
2. Реакцією утворення надхромових кислот підтверджують наявність перекису водню.
Випускається гидроперит в таблетках (1 таблетка відповідає 15 мл 3 % перекису водню).
Кількісне визначення. Йодометрія; (5 = 1 /2). Вміст водню пероксиду -35 %.
Магнію пероксид (Маgnesii регохуdum)
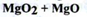
Отримання.

Властивості. Білий порошок без запаху.
Розчинність. Практично не розчиняється у воді, розчинний у мінеральних кислотах і в киплячій оцтової кислоті з виділенням вуглекислого газу.
Ідентифікація.
1. Реакція на М § 2 + після розчинення в кислоті хлористоводневої.
2.Реакція утворення надхромових кислот.
Кількісневизначення. Перманганатометрія без індикатора, (s = 2,5):
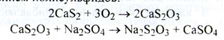
У препараті повинно бути не менше 25,9 % магнію пероксиду.
Застосування препаратів водню пероксиду:
антисептичні, дезодоруючі і депігментірующіе кошти. Магнію пероксид застосовують всередину при захворюваннях шлунка і кишечника.
Препарати, що містять сірку
Натрію тіосульфат (Natrii thiosulfas) (ДФУ)
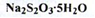
Отримання. окисленням полісульфатів.
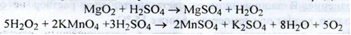
Властивості. Безбарвні прозорі кристали. На сухому повітрі вивітрюється. Дуже легко розчинний у воді, практично не розчинний у 96 % спирті. Ідентифікація.
1. Субстанція знебарвлює розчин калію йодиду йодований ([ КІ3]) (ДФУ):
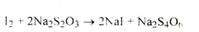
2. При додаванні до субстанції надлишку срібла нітрату утворюється білий осад, забарвлення якого поступово переходить в жовте, а потім у чорне (ДФУ):
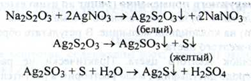
(чорний)
3. При додаванні до водного розчину субстанції кислоти хлористоводневої відбувається помутніння розчину, виділення газу, який забарвлює йодид крохмальний папір у синій колір (ДФУ):

3. Реакція (a) на Na+ (ДФУ).
Випробування на чистоту.
Сульфати і сульфіти. Попередньо до розчину субстанції додають розчин калію йодиду йодований до жовтого фарбування (для перетворення сульфітів в сульфати), а потім проводять визначення сульфатів з барію хлоридом.

Сульфіди - визначаються із натрієм нітропрусидом:
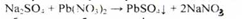
Не повинно з'являтися фіолетове забарвлення.
Кількісне визначення. Йодометрія (ДФУ); індикатор - крохмаль, (s = 2):

Застосування. Детоксичний, десенсибілізуючу засіб. Іноді як інсектицидний засіб.
Зберігання. У добре закупореній тарі.
Натрію сульфат декагідрат (Natrii sulfas decahydricus) (ДФУ)
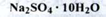
Властивості. Кристалічний порошок білого кольору або безбарвний, прозорі кристали. Легко розчинний у воді, практично не розчинний у 96 % спирті. Частково розчиняється в кристалізаційній воді при температурі близько 33 ° С.
Ідентифікація.
1,2. Реакції на натрій і сульфати (ДФУ).
3 Субстанція повинна витримувати вимоги випробування «Втрата в масі при висушуванні», зазначені в розділі «Випробування на чистоту» (ДФУ).
Кількісне визначення.
1. Субстанцію титрують розчином свинцю нітрату в присутності кислоти хлористоводневої і метанолу, потенціометрично. Перерахунок ведуть на суху речовину, (s =1) (ДФУ).
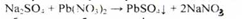
2. Гравіметрія (за утворенням барію сульфату).
Застосування. Проносний засіб.
Зберігання. У добре закупореній тарі.
Сірка для зовнішнього застосування
(Sulfur ad usum externum) (ДФУ)
Отримання. Отримують шляхом ретельного розмелювання очищеної сірки (Sulfur depuratum) на колоїдному млині. У результаті утворюється аморфний порошок блідо -жовтого кольору.
Властивості. Порошок жовтого кольору. Практично не розчинний у воді, розчинний у вуглеці дисульфідом, мало розчинний у рослинних маслах. (Розмір більшості частинок не перевищує 20 мкм, а розмір майже всіх часток не перевищує 40 мкм. Плавиться при температурі близько 120 ° С).
Ідентифікація.
1. Горить синім полум'ям з виділенням S02, який забарвлює вологу синім лакмусом папір у червоний колір (ДФУ).
2. Субстанцію нагрівають з бромної водою до знебарвлення розчину, фільтрують. Отриманий розчин дає реакцію (а) на сульфати (ДФУ).
3. Розчин субстанції в гарячому піридині в присутності бікарбонату натрію при кип'ятінні забарвлюється в блакитний або зелений колір.
Кількісне визначення.
1. Алкаліметрія після спалювання в колбі з киснем (ДФУ).
Субстанцію попередньо спалюють у колбі з киснем; залишок після спалювання абсорбують в суміші розчину водню пероксиду розведеного та води, нагрівають до кипіння. Отриману суміш охолоджують і титрують 0.1 М розчином натрію гідроксиду за фенолфталеїном. Паралельно проводять контрольний досвід, (s = 1 /2).
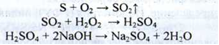
2. Алкаліметрія (зворотне титрування); (індикатор - метиловий оранжевий). Паралельно проводять контрольний досвід (s = 1 /2).
Субстанцію розчиняють у титрованому спиртовому розчині калію гідроксиду:
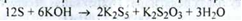
Спирт відганяють, розчин розбавляють водою, додають розчин водню пероксиду концентрований:
Сумарно: 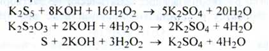
Надлишок калію гідроксиду визначають ацидиметрією:
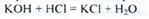
Застосування. Зовнішньо при лікуванні шкірних захворювань - псоріазу, корости, силікозу та ін. В якості протиглисного засобу при ентеробіозі.
Зберігання. У захищеному від світла місці.
Лікарські речовини, що містять елементи III, IV і V груп періодичної системи Д.І. Менделєєва
|
|
Дата добавления: 2015-05-26; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!