
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема. Історичні відомості про способи класифікації хімічних елементів
|
|
|
|
УРОК40
Цілі уроку: проаналізувати тематичне оцінювання та здійснити коригування знань учнів з теми «Класи неорганічних сполук»; розкрити необхідність наукової класифікації хімічних елементів і показати недосконалість перших спроб класифікації елементів; розширити знання про хімічні елементи, характерні ознаки простих речовин, утворених металами й неметалами.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, фронтальна евристична бесіда, робота з навчальною літературою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, плакат «Приклади спроб класифікації хімічних елементів».
ХІД УРОКУ
I. Організація класу
Вступне слово вчителя, загальні відомості про місце досліджуваної теми в курсі хімії в школі, оголошення теми, плану й основних цілей теми.
II. Актуалізація опорних знань
Фронтальна бесіда за основними поняттями хімії
• Як називається найменша неподільна частинка хімічного елемента, що входить до складу молекул простих і складних речовин? (Атом)
• Що таке хімічний елемент? (Тип атомів, що характеризуються певною сукупністю властивостей)
• Що таке молекули? (Це дрібні частинки, з яких складаються речовини та які мають усі властивості цієї речовини)
Згадаймо класифікацію хімічних елементів і речовин.

Оксиди — складні речовини, що складаються з двох елементів, один із яких — Оксиген.
Основи — складні речовини, до складу яких входять атоми металів, з'єднані з однією або кількома гідроксигрупами.
Кислоти — складні речовини, що складаються з атомів Гідрогену, здатних заміщатися на атоми металів, і кислотних залишків.
Солі — складні речовини, утворені атомами металів і кислотних залишків.
|
|
|
Відносна атомна маса елемента показує, у скільки разів маса його атома більша за 1/12 маси атома Карбону-12.
Відносна молекулярна маса — це фізична величина, що показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону-12.
Завдання 1
Обчисліть відносні молекулярні маси таких речовин:
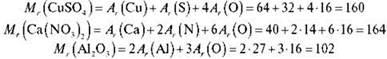
Валентність — це здатність атомів хімічного елемента приєднувати певне число атомів інших хімічних елементів.
Завдання 2
Визначте валентність атомів хімічних елементів у молекулах: MgO, НСl, Na2O, Аl2O3, H2S.
Завдання 3
Запишіть формули сполук Калію, Кальцію, Сульфуру з Оксигеном.
III. Вивчення нового матеріалу
1. Вступне слово вчителя
Першими металами, на які людина звернула увагу, були самородні мідь і золото. Люди бронзового століття довідалися про існування заліза — більш твердого металу, ніж бронза. Важливу роль у розвитку хімії як науки відіграли філософи Давньої Греції.
— Які елементи-стихії виділяли давні греки?
Давні греки вважали, що основними елементами є вода, земля, повітря й вогонь. Кожен з елементів-стихій є носієм двох властивостей. Схема Аристотеля передбачала чотири комбінації: вогонь — гарячий і сухий, повітря — гаряче й вологе, земля — холодна й суха, вода — холодна й волога.
За 300 р. до н. е. в Олександрії були відомі сім небесних тіл, що постійно змінюють своє положення й тому названих «планетами» («мандрівними зірками»), І відомі сім металів: золото, срібло, мідь, залізо, олово, свинець і ртуть. Чому б не об'єднати їх у пари? Саме тоді золото почали співвідносити із Сонцем, срібло — із Місяцем, мідь — із Венерою тощо.
У XVIII столітті були відкриті такі газоподібні елементи, як азот, водень, кисень і хлор, і такі метали, як кобальт, платина, нікель, манган, вольфрам, молібден, уран, титан і хром. До 70-х pp.позаминулого століття було вже відомо понад 60 хімічних елементів. У хімії, як і в інших природничих науках (ботаніка, зоологія), у міру накопичення фактів виникла необхідність у їхній класифікації.
|
|
|
Спочатку вчені намагалися розділити всі хімічні елементи на дві групи — метали й неметали.
— Які елементи називаються металами? неметалами?
В основу розподілу простих речовин були покладені як фізичні властивості (металевий блиск, хороша електро- й теплопровідність для металів і відсутність металевого блиску й відносно погана тепло- й електропровідність для неметалів), так і хімічні (здатність утворювати: для металів — переважно основні оксиди й відповідні їм гідроксиди — основи, для неметалів — кислотні оксиди й відповідні їм гідроксиди — кислоти). Неметали, на відміну від металів, утворюють із воднем леткі сполуки. Типові метали в сполуках з Оксигеном проявляють низьку валентність (I, II, III), тоді як типові неметали — високу (VII, VI, V, IV).
Під час вивчення найважливіших класів неорганічних сполук ми з'ясували, що типові метали відрізняються від типових неметалів не лише за фізичними, але й за хімічними властивостями. Типові метали, як, наприклад, кальцій Са, утворюють основні оксиди, яким відповідають основи:
СаО + Н2O  Са(ОН)2
Са(ОН)2
— Доведіть, що кальцій оксид — основний оксид.
Неметали, наприклад сірка, утворюють кислотні оксиди, яким відповідають кислоти:
SO3 + Н2O  H2SO4
H2SO4
— Доведіть, що сульфур(ІV) оксид — кислотний оксид.
Метали реагують із кислотами, як правило, заміщуючи в них атоми Гідрогену, з утворенням солей. Для неметалів реакція з кислотами не характерна.
Згодом з'ясувалося, що класифікація хімічних елементів на метали й неметали є неповною. Виявляється, існують хімічні елементи й відповідні їм речовини, що проявляють двоїсту природу.
— Як називаються такі елементи та їхні сполуки?
Цинк гідроксид Zn(OH)2 має властивості основи (реагує з кислотами) і кислоти (реагує з лугами), тобто має двоїсту природу.
— Доведіть амфотерність цинк гідроксиду.
Із сильною кислотою, наприклад із хлоридною, цинк гідроксид реагує як основа:
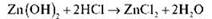
Із сильною основою, наприклад з натрій гідроксидом, цинк гідроксид реагує як кислота:
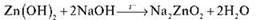
Такі ж двоїсті властивості характерні й для цинк оксиду:
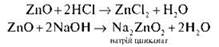
Оксиди й гідроксиди, здатні реагувати й із кислотами, і з лугами, називають амфотерними (від грецьк. амфотерос — «обидва», «той і інший»),
|
|
|
2. Поняття про групи подібних елементів
Учені-хіміки робили також спроби класифікувати хімічні елементи, об'єднуючи їх в окремі групи відповідно до їхніх властивостей. Підчас знайомства з киснем і залізом — простими речовинами, і складними (основними класами неорганічних сполук — оксидами, основами, кислотами й солями) ви вже зустрічалися з хімічними елементами, що утворюють сполуки з подібними властивостями. Наприклад, метали в процесі взаємодії з киснем утворюють основні оксиди, а неметали — кислотні оксиди.
— За якими ще ознаками можна об'єднати хімічні елементи та їхні сполуки в групи?
• За валентністю;
• за розчинністю у воді;
• за агрегатним станом;
• за складом;
• за відношенням до повітря (кисню);
• за температурами плавлення й кипіння тощо.
Спробуємо здійснити таку класифікацію.
Завдання 4
Розподіліть запропоновані хімічні елементи на чотири групи: Гелій, Натрій, Хлор, Калій, Купрум, Меркурій, Бром, Аргон.
Метали: Калій, Купрум, Меркурій; неметали: Хлор, Бром; інертні елементи: Неон, Аргон.
За розчинністю у воді: Натрій, Калій, Бром, Хлор — взаємодіють із водою; Купрум, Меркурій, Гелій, Аргон — нерозчинні у воді.
За відношенням до кисню повітря: легко окиснюються — Натрій, Калій; не окислюються на повітрі: Гелій, Аргон, Купрум, Меркурій.
Висновок. Класифікація за однією з ознак не дає бажаного результату. Необхідно розглянути їх у сукупності.
Група 1. Натрій, Калій — активні метали, тверді, валентність І, розчинні у воді, легко окислюються на повітрі — лужні метали.
Група 2. Хлор, Бром — неметали, валентність змінна, розчинні у воді, не окислюються на повітрі — галогени.
Група 3. Купрум, Меркурій — малоактивні метали, валентність змінна, нерозчинні у воді, не окислюються на повітрі.
Група 4. Гелій, Аргон — не взаємодіють з іншими речовинами, не утворюють сполуки з іншими хімічними елементами — інертні елементи.
На наступних уроках ми продовжимо вивчення класифікації хімічних елементів. Для цього запишіть домашнє завдання.
IV. Домашнє завдання
Опрацювати відповідний параграф підручника і відповісти на запитання.
Творче завдання. Підготувати інформацію про одну з груп хімічних елементів: «Галогени», «Лужні метали», «Інертні елементи». Скласти ребуси з назвами цих елементів.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 706; Нарушение авторских прав?; Мы поможем в написании вашей работы!