
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация воды. Водородный показатель. Нейтральная, кислая и основная среды
|
|
|
|
Вода является очень слабым электролитом. Электролитическая диссоциация воды выражается следующим уравнением:
Н2О <=> Н+ + ОН-.
Это обратимый процесс. Константа диссоциации воды запишется
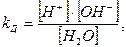
умножая левую и правую части выражения на [H2O],
получим 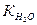 = [Н+]∙[ОН-],
= [Н+]∙[ОН-],
где 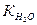 = Кд∙[H2O] и называется ионным произведением воды.
= Кд∙[H2O] и называется ионным произведением воды.
Это уравнение показывает, что при постоянной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная.
При 220С [Н+]∙[ОН-] = 10-14 мол/л. В воде [Н+] = [ОН-] = 10-7 мол/л.
В зависимости от концентрации ионов водорода различают нейтральную, кислую и основную (щелочную) среду (растворы).
Растворы, в которых [Н+] = 10-7 мол/л – нейтральные растворы. В нейтральных растворах присутствуют ионы H+ и OH-. Концентрации ионов равны 10-7 мол/л.
Растворы, в которых [Н+] > 10-7 мол/л – кислые растворы. В кислых растворах присутствуют ионы H+ и OH-. Однако концентрация ионов H+ (например, 10-6, 10-5 и т.д.) выше концентрации OH- (например, 10-8 , 10-9 ).
Растворы, в которых [Н+] < 10-7 мол/л – щелочные растворы. В щелочных растворах присутствуют ионы H+ и OH-. Однако концентрация ионов H+ (например 10-8, 10-9 и т.д.) ниже концентрации OH-.
В 0,01 М растворе HCl при 250С [Н+] = 0,01 = 10-2 мол/л, т.к. HCl – сильный электролит и a = 1. При этом концентрация гидроксид ионов [ОН-]= 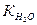 / [Н+] = 10-14 / 10-2 = 10-12 мол/л.
/ [Н+] = 10-14 / 10-2 = 10-12 мол/л.
Для характеристики среды пользуются не значением концентрации ионов водорода [Н+], а величиной водородного показателя (рН):
рН = -lg[Н+],
рН = 7 – нейтральная среда,
рН < 7 – кислая среда,
рН > 7 – щелочная среда.
Для 0,01 М раствора HCl [H+] = 10-2 мол/л, рН = - lg 10-2 = 2,
для 0,01 М раствора NaOH рН = - lg 10-12 = 12.
ЗАДАНИЕ
101. Сколько граммов вещества нужно взять для приготовления 400мл 10%масс. раствора карбоната натрия из кристаллогидрата Na2CO3 ∙ 10H2O (d204 раствора = 1,05 г/мл)?
|
|
|
102.Определить молярную и эквивалентную (нормальность) концентрации раствора, содержащего в 1000мл раствора 49г фосфорной кислоты.
103. Смешали 300г 25%масс. раствора этиленгликоля и 400г 40%масс. раствора этиленгликоля. Определить массовую долю этиленгликоля в полученном растворе.
104.В 0,5кг воды растворено 300г карбоната натрия. Определить моляльную концентрацию раствора.
105.Температура кипения водного раствора сахарозы (С12Н22О11) равна 101,4оС. Вычислить массовую долю сахарозы в растворе.
106.Сколько граммов вещества нужно взять для приготовления 2л 5%масс. раствора сульфата натрия из кристаллогидрата Na2SO4·10H2O (d204 раствора = 1,08 г/мл)?
107.Определить молярную и эквивалентную (нормальность) концентрации раствора, содержащего в 103г раствора 31,5г азотной кислоты (d204 раствора = 1,03 г/мл).
108.Сколько надо взять 20%масс. раствора гидроксида калия, чтобы при добавлении к 1кг 50%масс. раствора получился 25%масс. раствор?
109.При какой температуре будет кипеть 50%масс. водный раствор ацетона (С3Н6О)?
110.В 100г воды растворено 3,5г хлорида кальция. Определить моляльную концентрацию раствора.
111.Сколько граммов вещества нужно взять для приготовления 500г 25%масс. раствора сульфата меди из кристаллогидрата CuSO4 ·5H2O?
112Определить молярную и эквивалентную (нормальность) концентрации раствора, содержащего в 100мл раствора 5,6г гидроксида калия.
113.К 500г 30%масс. раствора аммиака (d204 раствора = 1,09 г/мл) добавили 1л воды. Чему равна массовая доля аммиака в полученном растворе?
114.В 200г воды растворено 15г сульфата магния. Определить моляльную концентрацию раствора.
115.В 100г воды содержится 7,2г глюкозы (С6Н12О6). Определить температуру замерзания раствора.
116.Какой объём 12%масс. раствора гидроксида калия (d204 = 1,1 г/мл) можно приготовить из 2 л 44 % масс. раствора (d204= 1,5 г/мл)?
|
|
|
117.Определить молярную и эквивалентную (нормальность) концентрации раствора, содержащего в 250мл 22,2г хлорида кальция.
118.Приготовили антифриз – водный раствор диэтиленгликоля (С4Н10О3). Определить массовую долю диэтиленгликоля в растворе, если температура замерзания раствора минус 20оС.
119.В 250г воды растворено 9г нитрата натрия. Определить моляльную концентрацию полученного раствора.
120.Сколько граммов вещества нужно взять для приготовления 400мл 20%масс. раствора хлорида кальция из кристаллогидрата CaCl2 · 6H2O (d204 раствора = 1,2 г/мл)?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 546; Нарушение авторских прав?; Мы поможем в написании вашей работы!