
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ядерный остов молекул
|
|
|
|
Наиболее существенным отличием молекул от атомов является наличие нескольких атомных ядер, составляющих, в совокупности ядерный остов молекулы. Относительное расположение ядер в пространстве можно задать совокупностью межъядерных расстояний { r ij}. Ядра молекулы не закреплены какими-либо жесткими связями и могут перемещаться относительно друг друга, так что межъядерные расстояния оказываются переменными величинами. Для описания всех возможных состояний ядерного остова удобно использовать т.н. "конфигурационное пространство" (КП), координатным осям в котором соответствуют отдельные межъядерные расстояния. Каждая точка КП изображает некоторую конкретную пространственную конфигурацию ядерного остова молекулы. Например, для трехядерной молекулы воды КП будет аналогичным обычному трехмерному евклидовому пространству:
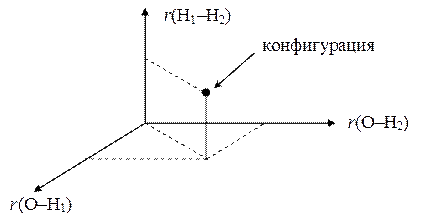
Знание конфигурации молекулы важно в том отношении, что от межъядерных расстояний зависит характер движения электронов и, следовательно, суммарная электронная энергия молекулы Е эл. Кроме того, электрические заряды ядер порождают кулоновские силы отталкивания между ними, с которыми связан еще один вклад в полную энергию молекулы — Е яд. Эта ядерная энергия также зависит от межъядерных расстояний. В результате можно определить функцию: Е = Е эл + Е яд = f (rij), которая является важной характеристикой любой молекулы. Она называется поверхностью потенциальной энергии (ППЭ). Точный вид ППЭ (за исключением простейших молеклу типа Н2) неизвестен. Однако для любой заданной конфигурации (конкретной точки КП) ее значение можно вычислить методами ВС и МО. Повторяя такие расчеты для множества соседних точек КП, можно с достаточной точностью построить любой интересующий нас фрагмент ППЭ.
|
|
|
В простых случаях можно построить график этой функции. Например, для двухатомных молекул конфигурационное пространство одномерно и представляет собой прямую линию (r),. Соответственно, графиком ППЭ является одномерная кривая: E = f (r):
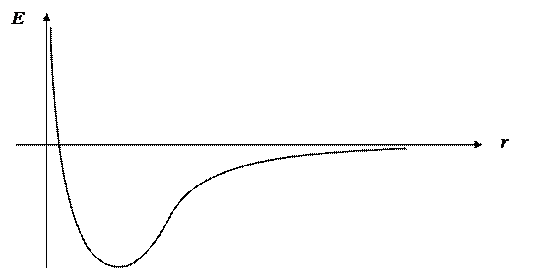 |
Для двумерного (плоского) конфигурационного пространства график ППЭ представляет собой искривленную двумерную поверхность, а в более сложных случаях — гиперповерхность той же размерности, что и само КП.
Для описания особенностей ППЭ можно использовать два приема:
а) энергетические карты,
б) энергетические профили.
Энергетическая карта ППЭ представляет собой совокупность уровней постоянной энергии E = const. Ее размерность такая же, как у КП, и поэтому карта является наглядной только для простых молекул.
Энергетический профиль — это сечение ППЭ вертикальной поверхностью, обычно соответствующей некоторому направлению в КП (определенное межъядерное расстояние или их комбинация). Профиль всегда двумерный, и поэтому данный метод пригоден для любых случаев.
Молекулы, как и атомы, являются агрегатами из атомных ядер и электронов. Однако существенным отличием молекул является наличие нескольких атомных ядер, составляющих в совокупности ядерный остов молекулы. Это приводит к появлению у молекул целого ряда дополнительных характеристик. Выделим основные из них.
1) Пространственные (геометрические) характеристики. В отличие от электронов, каждое атомное ядро можно охарактеризовать определенным (средним) положением в пространстве относительно остальных ядер молекулы. Соответственно, вся совокупность ядер молекулы обладает определенной пространственной конфигурацией, характеризующей такие относительные положения ядер, и которую удобно описывать:
а) совокупностью межъядерных расстояний { rij },
|
|
|
б) определенной геометрической моделью — ядерным полиэдром (отрезок прямой, угол, треугольник, квадрат, тетраэдр, пирамида, бипирамида, октаэдр и т.д.)
У атомов подобные геометрические характеристики отсутствуют. Более того, все атомы в геометрическом отношении совершенно однотипны — их можно описать единственной моделью «шар», форма которой обусловлена сферической симметрией электрического поля единственного атомного ядра.
2) Кинематика. Ядра молекулы не закреплены какими-либо жесткими связями и могут перемещаться относительно друг друга. (Амплитуда этих движений невелика, так что в результате пространственная форма молекулы может искажаться, но не изменять свой тип. Так, в пирамидальной молекуле аммиака при относительном движении ядер искажаются валентные углы между связями N–H, но форма молекулы остается пирамидальной.) Следовательно, молекулы имеют дополнительные степени свободы, связанные с изменением межъядерных расстояний. Другими словами, молекуле можно приписать множество состояний, каждое из которые характеризуется определенной пространственной конфигурацией ядерного остова. Полная совокупность таких состояний образует особое пространство состояний, которое называется конфигурационным пространством (КП), координатные оси которого соответствуют межъядерным расстояниям. Например, для молекулы воды (и других трехъядерных молекул) КП является трехмерным:
 |
3) Энергия. Атомные ядра имеют одноименные электрические заряды и отталкиваются друг от друга. Это приводит к появлению специфического вклада в полную энергию — ядерной энергии молекулы:
Е = Е эл. + Е яд.
Ядерная энергия, очевидно, зависит от химической природы атомов (зарядов ядер), образующих молекулу, и от ее пространственной конфигурации:
Е яд = f (rij, Zk)
Кроме того, характер движения электронов существенным образом зависит от суммарного электрического поля, создаваемого ядрами. Следовательно, и энергия электронной оболочки, и полная энергия молекулы зависят от ядерного остова:
Е = Е эл. + Е яд. = g (rij, Zk) + f (rij, Zk)
4) Силы. Поскольку энергия молекулы явным образом зависит от конфигурации ядерного остова, то при любых изменениях межъядерных расстояний внутри молекулы будут возникать механические силы притяжения или отталкивания:
|
|
|
Fij = – dE / drij
которые, в общем случае, должны вызывать относительные перемещения ядер. Опыт говорит о том, что молекулы, как правило, существуют в устойчивых, стационарных состояниях с неизменными межъядерными расстояниями. Отсюда следует, что таким состояниям соответствуют минимумы полной энергии молекулы, когда все силы полностью уравновешены.
{Стационарное состояние} Û Е мин. Û å Fij = 0
Для решения указанных проблем, связанных с дополнительными характеристиками молекул, удобно использовать специальную модель — поверхность потенциальной энергии (ППЭ), которую можно определить как функцию:
E = f (rij),
где Е — полная внутренняя энергия молекулы, включающая энергию электронной оболочки и энергию межъядерного отталкивания (ее можно рассчитать методами ВС и МО).
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1089; Нарушение авторских прав?; Мы поможем в написании вашей работы!