
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа равновесия химической реакции
Наряду с химическим взаимодействием между исходными веществами (прямой реакции) происходит химическое взаимодействие и между продуктами реакции, т.е. обратная реакция.
По мере протекания процесса скорость прямой реакции уменьшается, в то время как скорость обратной реакции увеличивается. При равенстве этих скоростей наступает химическое равновесие.
Т.о., химическим равновесием называется такое состояние обратимого процесса:
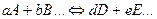
при котором скорость прямой реакции

равна скорости обратной реакции
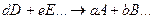
При химическом равновесии отношение произведения молярных концентраций веществ, получающихся при реакции, к произведению молярных концентраций исходных веществ есть постоянная величина для данного химического процесса при заданных условиях протекания реакции.
С момента наступления равновесия в реагирующей системе концентрации и парциальные давления веществ не изменяются. Поэтому для процессов, протекающих при 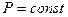 и
и  , будут неизменными и отношения
, будут неизменными и отношения
 ;
;
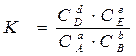 ,
,
где: 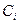 и
и 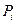 - соответственно равновесные концентрации и парциальные давления.
- соответственно равновесные концентрации и парциальные давления.
 и
и 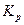 называются константами химического равновесия.
называются константами химического равновесия.
Между  и
и 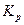 существует взаимосвязь, которая выражается следующим уравнением:
существует взаимосвязь, которая выражается следующим уравнением:
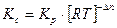 ,
,
где:  - разность числа молей газообразных веществ:
- разность числа молей газообразных веществ:

В данном случае справедлив закон Дальтона:
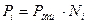 ,
,
где: 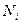 - мольная доля, равная отношению числа молей i-компонента к сумме чисел молей всех компонентов системы.
- мольная доля, равная отношению числа молей i-компонента к сумме чисел молей всех компонентов системы.
При очень большом значении константы равновесия реакция может идти практически до конца, при очень малом – не протекает вообще.
Константа химического равновесия зависит от природы реагентов и от температуры, и в меньшей степени зависит от давления (если давления не высокие), от концентраций, наличия или отсутствия примесей.
Если парциальные давления начальных и конечных продуктов реакции в исходной смеси равны  1ат, т.е. они находятся в стандартном состоянии, то изменение стандартной энергии Гиббса выражается зависимостью:
1ат, т.е. они находятся в стандартном состоянии, то изменение стандартной энергии Гиббса выражается зависимостью:
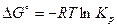 , откуда
, откуда 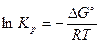
Из этого уравнения следует, что большим отрицательным значениям 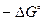 отвечает большее значение
отвечает большее значение 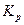 , т.е. преобладание в равновесной смеси продуктов взаимодействия. Наоборот, если
, т.е. преобладание в равновесной смеси продуктов взаимодействия. Наоборот, если  , то в равновесной смеси будут преобладать исходные вещества.
, то в равновесной смеси будут преобладать исходные вещества.
Следовательно, в первом случае можно пренебречь наличием исходных веществ, во втором – наличием продуктов реакции. Если же 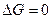 , то
, то 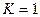 .
.
Объединение двух уравнений:
 и
и 
с последующим преобразованием их дает уравнение:
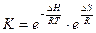 ,
,
которое отражает противоположное влияние на равновесие энтальпийного и энтропийного факторов. Это соотношение позволяет определить возможную глубину реакции, допускаемую в термодинамике.
|
|
Дата добавления: 2015-06-25; Просмотров: 494; Нарушение авторских прав?; Мы поможем в написании вашей работы!