
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение и свойства галогенов
|
|
|
|
ХИМИЯ ЭЛЕМЕНТОВ
НЕОРГАНИЧЕСКАЯ ХИМИЯ
ЛАБОРАТОРНЫЕ РАБОТЫ
Методические указания для студентов направления
020100 Химия
Форма обучения очная
Часть II
Тула 2012г.
Методические указания составлены проф. каф. химии, к.х.н. В.А. Алферовым, доц. каф. химии, к.х.н. Л.Д. Асулян, доц. каф. химии, к.х.н. С.Ф. Хлебниковой, доц. каф. химии, к.х.н. Е.Д. Дмитриевой, доц. каф. химии, к.х.н. А.А. Горячевой.
Методические указания составлены на основании Федерального государственного образовательного стандарта высшего профессионального образования, утвержденного Министерством образования и науки Российской федерации 19 мая 2010 г. для направления 020100 Химия, квалификация – бакалавр химии.
ОГЛАВЛЕНИЕ
Лабораторная работа №1...................................................................... 4
Получение и свойства галогенов............................................................ 4
Лабораторная работа №2...................................................................... 8
Элементы VIА группы и их соединения............................................... 8
Лабораторная работа № 3................................................................... 10
Изучение свойств соединений азота..................................................... 10
Лабораторная работа №4.................................................................... 13
Фосфор..................................................................................................... 13
Лабораторная работа №5.................................................................... 15
Получение и свойства соединений углерода и кремния................... 15
Лабораторная работа №6.................................................................... 19
Получение и свойства соединений олова и свинца............................ 19
Лабораторная работа №7.................................................................... 22
Получение и свойства соединений бора и алюминия........................ 22
Лабораторная работа №8.................................................................. 24
|
|
|
Подгруппа меди (Cu, Ag, Au)............................................................... 24
Лабораторная работа №9.................................................................. 27
Подгруппа цинка (Zn, Cd, Hg)........................................................... 27
Лабораторная работа № 10............................................................... 29
Металлы IVВ и VВ групп..................................................................... 29
Лабораторная работа № 11............................................................... 31
Металлы VIВ группы........................................................................... 31
Лабораторная работа № 12............................................................... 34
Металлы VII В группы.......................................................................... 34
Лабораторная работа № 13............................................................... 37
Металлы VIII B группы........................................................................ 37
Лабораторная работа №1
Цель работы: познакомиться со свойствами галогенов и их соединений.
Необходимые реактивы: оксид марганца (IV), перманганат калия, бихромат калия, железная и медная проволока, алюминиевая фольга, хлорид натрия, бромид натрия (кристаллический и насыщенный раствор), йодид калия, йод, бром, гидроксид кальция, хлористоводородная кислота 36%-ная, серная кислота 96% и 1н растворы, гидроксид натрия 1н раствор, гидроксид калия 50%-ный раствор, раствор нитрата серебра, сахарная пудра, хлороформ, бензол, четыреххлористый углерод, лакмус, охлаждающая смесь (лед и хлорид натрия)
Необходимое оборудование: химические пробирки, промывные склянки (Тищенко) - 2-3 шт., колба Вюрца на 250 мл, колбы плоскодонные на 50 мл – 5 шт., толстостенный пузырек на 50 мл с пробкой и капилляром, ложечка для сжигания, резиновая пробка с газоотводной трубкой, фарфоровые тигли и чашки, маленькие конические воронки, капельная воронка, химический стакан на 50-100 мл.
Внимание! Опыты с галогенами следует проводить под тягой! Необходимо работать в перчатках. Все работы с галогенами, особенно бромом, можно проводить только с разрешения преподавателя!
|
|
|
1.1 Получение хлора и изучение его свойств.
1.1.1. Положить в пробирку 2-3 кристалла перманганата калия и поставить ее в штатив. Осторожно прилить несколько капель концентрированной хлористоводородной кислоты. Что наблюдается? Написать уравнение реакции в молекулярном и электронно-ионном виде.
1.1.2. Поместить на дно пробирки немного тонко измельченного дихромата калия и облить его концентрированной хлористоводородной кислотой. Смесь слегка подогреть. Что наблюдается? Написать уравнение реакции в молекулярном и электронно-ионном виде.
1.1.3. Поместить в пробирку немного смеси хлорида натрия с оксидом марганца (IV), осторожно прилить из пипетки несколько капель концентрированной серной кислоты. Смесь слегка подогреть. Что наблюдается? Написать уравнение реакции в молекулярном и электронно-ионном виде.
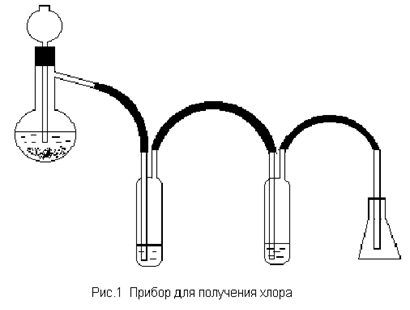
1.1.4. Собрать прибор (Рис.1).
Налить в первую промывалку воды (зачем?), во вторую – концентрированную серную кислоту (зачем?). Насыпать в колбу емкостью 250 мл 20 г оксида марганца (IV) и прилить столько хлористоводородной кислоты, чтобы она закрыла оксид марганца (IV) и конец трубки. Когда ток газа замедлится, слабо подогреть реакционную колбу
Наполнить хлором 3 конические колбы на 50 мл и покрыть стеклянными пластинками. На дно банки, предназначенной для сжигания в хлоре металла, предварительно поместить слой песка (зачем?) Во время заполнения хлором отверстия банок должны быть прикрыты стеклянными пластинками или листами бумаги. Поставить белый экран (лист бумаги) для наблюдения окраски хлора. Испытать свойства хлора.
 |
1.1.5. Взаимодействие хлора с металлами. Взять щипцами полоску медной фольги или пучок тонких медных проволочек, нагреть на пламени горелки и быстро внести в банку с хлором. Что наблюдается? Написать уравнение реакции.
1.1.6. Взаимодействие хлора с неметаллами. Положить в ложечку для сжигания несколько крупинок красного фосфора, поджечь его и внести в банку с хлором. Что происходит? Написать уравнение реакции.
В каких условиях при горении фосфора в хлоре могут образоваться хлориды фосфора (III) и фосфора (V)? По каким признакам их можно отличить?
1.1.7. Хлорная вода и ее свойства. Насытить 5-10 мл дистиллированной воды хлором, для чего газоотводную трубку прибора (рис. 1) опустить в пробирку с водой и пропускать газ в течение 5-10 мин. Отметить цвет и запах (осторожно!) полученного раствора. Какие вещества присутствуют в хлорной воде? Написать уравнение реакции. Испытать действие полученной хлорной воды на окрашенную ткань. Что наблюдается? Какое вещество производит белящее действие?
|
|
|
Налить в пробирку 2-3 мл хлорной воды и прибавить по каплям раствор гидроксида натрия. Как объяснить исчезновение окраски и запаха хлорной воды? Какое влияние оказывает щелочь на сдвиг равновесия в реакции между хлором и водой? Сформулировать принцип Ле-Шателье.
Добавить в пробирку разбавленный раствор серной кислоты до кислой реакции. Изменился ли запах раствора? Написать уравнение реакции.
1.2. Изучение свойств брома.
Опыты с жидким бромом студент проводит в присутствии преподавателя!
1.2.1. В вытяжной шкаф поставить штатив с 5 сухими пробирками. Пользуясь маленькой воронокой, налить в каждую пробирку по 0,3-0,5 мл брома и проделать следующие опыты.
1.2.1.1. Одну пробирку с бромом поместить в стакан с охлаждающей смесью (лед и хлорид натрия), температура которой не должна быть выше -100С. Какова температура замерзания брома?
1.2.1.2. Пробирку с бромом закрепить в лапке штатива и бросить в нее узкую полоску алюминиевой фольги. Если через минуту реакция не начнется, подвести под дно пробирки стакан с теплой водой (~ 400С). Что происходит? Написать уравнение реакции.
1.2.1.3. В пробирку с бромом, также закрепленную в лапке штатива, внести нагретую полоску медной фольги. Что наблюдается? Написать уравнение реакции.
1.2.1.4. В четвертую пробирку с бромом, находящуюся в штативе, внести шпателем несколько крупинок красного фосфора. Написать уравнение реакции.
1.2.1.5. В пробирку с бромом добавить 3-5 мл воды и перемешать стеклянной палочкой содержимое пробирки. Что наблюдается? Какова растворимость брома в воде? Что называется бромной водой? Прибавить к раствору несколько капель насыщенного раствора бромида калия. Объяснить происходящее явление.
|
|
|
1.2.1.6. Налить в пробирку 2-3 мл бромной воды и прилить раствор гидроксида натрия. Как можно объяснить изменение окраски раствора? Написать уравнение реакции.
1.2.1.7. Налить в пробирку несколько капель бромной воды, разбавить ее 5 мл дистиллированной воды и прибавить 5-10 капель хлороформа. Содержимое пробирки тщательно перемешать. Объяснить наблюдаемое явление. Отметить окраску органического слоя.
1.3. Изучение свойств йода
1.3.1. В фарфоровую чашку поместить несколько кристаллов сухого йода и порошка алюминия и осторожно перемешать. (Опыт проводить под тягой!) В приготовленную смесь внести каплю воды при помощи длинной трубки или палочки. Что наблюдается? Какую роль играет вода в данном опыте? Написать уравнение реакции.
1.3.2. Налить в две пробирки воду и опустить в них по одному кристаллу йода. Содержимое пробирок сильно взболтать. Какова растворимость йода в воде? Какие молекулы и ионы содержатся в йодной воде? Написать уравнение реакции взаимодействия йода с водой.
Оставить одну пробирку для сравнения, во вторую пробирку прилить насыщенный раствор йодида калия и сильно взболтать. Что происходит? Образованием какого вещества объясняется увеличение растворимости йода? Написать уравнение реакции.
1.3.3. К 2-3 мл йодной воды прилить по каплям 1н раствор щелочи до исчезновения окраски раствора. Полученный раствор подкислить серной кислотой. Что при этом наблюдается? Объяснить происходящие явления. Написать уравнения реакций.
1.3.4. Налить в ряд пробирок по 2-3 мл йодной воды и добавить в них по 2-3 капли органических растворителей (бензол, хлороформ, тетрахлорид углерода и др.). Содержимое пробирок взболтать и отметить окраску слоя органического растворителя. В чем заключается сущность закона распределения?
1.4. Соединения галогенов с водородом. (Опыты проводить под тягой!)
1.4.1. Взаимодействие галогенидов металлов с серной кислотой. Три пробирки поместить в штатив. В одну из них положить немного хлорида натрия, в другую – бромида натрия и в третью – йодида калия. В каждую из пробирок прилить несколько капель концентрированной серной кислоты (кислоту брать пипеткой!). Что наблюдается? Чем загрязнены бромид и йодид водорода, полученные этим способом? Написать уравнения реакций. Какой из галогеноводородов является наиболее сильным восстановителем?
1.4.2. Получение хлорида водорода. Собрать прибор (рис.1), заменив воронку без крана капельной воронкой и оставив одну промывалку с серной кислотой (в качестве осушителя и счетчика пузырьков). В реакционную колбу поместить 7-10 г хлорида натрия. В капельную воронку налить концентрированную серную кислоту (15-20 мл).
По каплям вводить серную кислоту в реакцию с хлоридом натрия. Наполнить сухую толстостенную склянку емкостью 25-30 мл выделяющимся хлоридом водорода. Как определить конец наполнения? Написать уравнение реакции.
1.4.3. Взаимодействие хлорида водорода с водой. Закрыть склянку с хлоридом водорода пробкой с капилляром, обращенным внутрь емкости. Повернуть склянку вверх дном, погрузить конец капиллярной трубки в воду, подкрашенную лакмусом (рис.2).
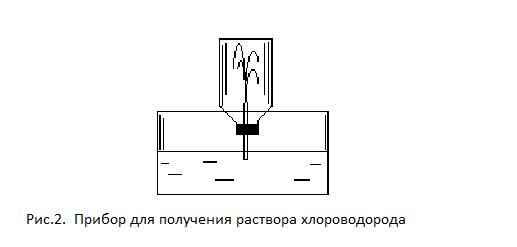 |
Объяснить происходящее явление. Какова растворимость хлорида водорода в воде? Каков состав азеотропной смеси хлористоводородной кислоты с водой?
Полученный раствор хлористоводородной кислоты отлить в сухой стаканчик (объемом 50 мл) и, пользуясь pH-метром, определить pH раствора, рассчитать концентрацию кислоты.
1.5. Кислородные соединения галогенов.
1.5.1. Получение белильной извести. К 2 г гидроксида кальция добавить 10-15 мл воды и хорошо перемешать. Полученную смесь поместить в маленький стакан, охлаждаемый льдом, и пропускать хлор в течение 10-20 мин (Получение хлора см. п.1.1.4.). Написать уравнение реакции.
1.5.2. Свойства белильной извести. Полученный в п. 1.5.1. препарат обработать 10 мл воды и отфильтровать не растворившиеся вещества. Взять небольшое количество полученного раствора и испытать действие его на окрашенную ткань. Объяснить наблюдаемое явление.
К части полученного раствора белильной извести прилить раствор 1н серной кислоты до кислой реакции и осторожно понюхать. Написать уравнение реакции. Что происходит с белильной известью при нагревании концентрированного раствора?
1.5.3. Свойства хлората калия.
1.5.3.1. В маленькую фарфоровую чашку положить несколько кристаллов бертолетовой соли и осторожно смочить их 3-4 каплями 96%-ного раствора серной кислоты. Что наблюдается? Проделать аналогичный опыт с концентрированной хлористоводородной кислотой. Что наблюдается в этом случае? Написать уравнения реакций.
1.5.3.2. Отвесить 0,5 г мелкокристаллического хлората калия и смешать палочкой (осторожно!) с равным количеством сахарной пудры. Высыпать смесь на крышку от тигля и смочить ее 2-3 каплями концентрированной серной кислоты. Что происходит? На какие свойства бертолетовой соли указывают проделанные опыты?
Лабораторная работа №2
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 1826; Нарушение авторских прав?; Мы поможем в написании вашей работы!