
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы гальванических элементов
|
|
|
|
В зависимости от природы и свойств электродов, из которых составлена электрохимическая система, различают химические и концентрационные цепи.
В химических цепях электроды отличаются друг от друга химическими свойствами. В этих цепях источником электрической энергии служит химическая, реакция Примером такого типа элементов является рассмотренный ранее элемент Даниэля-Якоби.
Концентрационными цепями называются цепи, в которых оба электрода одинаковы по своей природе, но различаются активностью одного или нескольких участников электродной реакции. При этом электрическая энергия получается за счет выравнивания концентраций веществ в элементе.
Например, гальванический элемент
Cu | CuSO4 || CuSO4 | Cu
C1 C2
При определении знаков электродов концентрационной цепи надо помнить, что положительным электродом будет тот электрод, в котором концентрация (активность) раствора выше. В рассматриваемом элементе, принимая во внимание то, что справа записывается положительный электрод, должно выполняться неравенство C1<C2 при этом на левом электроде идет растворение, а на правом - восстановление металла.
 Сu = Cu2+(C1) + 2e Cu2+(C2) + 2e = Cu
Сu = Cu2+(C1) + 2e Cu2+(C2) + 2e = Cu
Суммарный процесс:
Cu2+(C2) = Cu2+(C1)
ЭДС этого элемента запишется
E = 0.059/2· ℓg((aCu2+(C2)) / aCu2+(C1)) (32)
Концентрационными элементами являются и цепи с одним электролитом, до с электродами, отличающимися поколичественному составу, например, с амальгамными или газовыми электродами.
Например для амальгамного гальванического элемента.
 (Hg) M | MZ+| M (Hg)
(Hg) M | MZ+| M (Hg)
a1>a2 а ЭДС будет равна
E = 0.059/Z· ℓg(a1/a2) (33)
Для концентрационного элемента, составленного из двух водородных электродов, отличающихся давлением водорода (P1>P2) и имеющего один электролит
|
|
|
 Pt (H2) | H+ | Pt (H2)
Pt (H2) | H+ | Pt (H2)
P1 P2
ЭДС будет равна
E = 0.059/2· ℓg(P1/P2) (34)
По наличию или отсутствию диффузионных потенциалов элементы подразделяются на цепи с переносом и цепи без переноса.
Рассмотрим гальванический элемент, составленный из хлорсеребряного и хлорного электродов
 Ag | AgCl | Cl- | (Cl2) Pt
Ag | AgCl | Cl- | (Cl2) Pt
на катоде идет реакция 0.5Cl2 +e = Cl -
на аноде Ag + Cl - = AgCl + e
суммарная реакция 0.5Cl2 + Ag = AgCl
Согласно Уравнению Нернста и учитывая, что
aAg=1 aCl2 = PCl2,
ЭДС этого элемента запишется
E = φºCl2/Cl- - φºCl- /Ag, AgCl + 0,059∙ℓg PCl20.5 (35)
Т.е. ЭДС будет определяться давлением газообразного хлора, и не зависеть от концентрации хлор-ионов.
Рассмотренный гальванический элемент представляет собой цепь без переноса, т.к. в нем отсутствует диффузионный потенциал.
Примером концентрационного элемента с переносом является цепь.
Cu | CuSO4 ░ CuSO4 | Cu
C1 < C2
При отсутствии солевого моста на границе двух растворов возникает диффузионный потенциал. Механизм образования диффузионного потенциала можно объяснить следующим.
Поскольку концентрация раствора, в который опущен правый электрод, больше; ионы Сu2+ и SO42- будет диффундировать влево. Но подвижность ионов SO42- выше, чем Сu2+ и они будут диффундировать быстрее и поверхность соприкосновения будет заряжаться знаком более подвижных ионов со стороны разбавленного раствора. Образуется диффузионный двойной электрический слой. Разность потенциалов этого слоя носит название диффузионного потенциала.
В уравнении Нернста под знаком, логарифма входят активности ионов. Б настоящее время пет методов, которые дозволили бы экспериментальным путем- определить активность отдельных ионов, поэтому при описании свойств растворов электролитов пользуются понятием средней ионной активности, которой пользуются при. соответствующих расчетах вместо активности отдельных ионов.
|
|
|
Для электролита, Mν + Aν - диссоциирующего по схеме
Mν + Aν – D ν+ MZ+ +ν- AZ -
средняя ионная активность равна
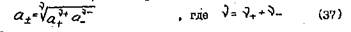
При описании растворов электролитов концентрацию чаще всего выражают в единицах молярности и активность отдельных ионов можно представить так:
a+=γ+m+ = γ+ ν+ m
a-=γ-m- = γ- ν- m
где γ+ и γ- коэффициенты активности катиона и аниона
m+ и m- молярная концентрация катиона и аниона,
m молярная концентрация раствора электролита.
С учетом этих уравнений средняя ионная активность запишется
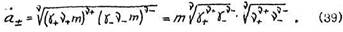
Величина VX!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!+ ol ~l+ ~ средний ионный коэффициент активности. Таким образом

Для бинарного электролита (NaCl, CuSO4)

Для.1-2 валентного электролита (Na2SO4)
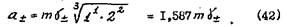
Для1-3 валентного электролита (AlCl3, K3Fe(CN)6)
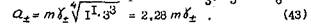
Для 2-3 валентного электролита Al2(SO4)3
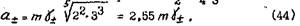
Значения средних ионных коэффициентов активностей берутся из справочника* В тех случаях, когда значение коэффициента активности неизвестно, можно для его расчета воспользоваться уравилшем Дебая-Гюккеля
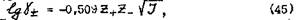
где Z+1и Z - - соответственно заряд катиона и аниона (берутся по абсолютной величине),
J - ионная сила раствора, определяемая по уравнению
J=1/2Σ( i ) mi zi2
в котором mi - моляльная концентрация I –го иона zi – заряд i-го иона.
Необходимо помнить, что уравнение Дебая-Гюккеля справедливо только для разбавленных растворов сильных электролитов для которых J < 0.01
Компенсационный метод измерения ЭДС, Для определения электродвижущей силы гальванического элемента пользуются компенсационным методом измерения, сущность которого состоит в том, что исследуемый гальванический элемент подключается к некоторому участку внешней электрической цепи таким образом, чтобы ток в цеди исследуемого элемента был равен нулю. При этом падение напряжения на участке внешней цепи по абсолютной величине равно ЭДС исследуемого элемента.
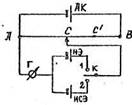
Рис.3 Принципиальная схема компенсационного метода измерения ЭДС:
АК - аккумулятор,
Г - нуль-инструмент,
К - ключ,
НЭ - нормальный элемент Вестона,
ВДЭ - исследуемый элемент,
АВ - калиброванная проволока.
Принцип работы этой схемы. Вначале компенсируют ЭДС нормального элементаBeстона» для этого устанавливают ключ в положение I Если ЕАК — ЭДС аккумулятора, включенного в
большую цепь, сопротивление которой равно RAB EНЭ нормального элемента и RAC - сопротивление отрезка проволоки соответствующее положению найденной точки компенсации С, то
|
|
|
ЕАК / RАВ =EНЭ / RАС, отсюда EAK = EНЭ · RAB/RAC (47)
или, заменяя отношение сопротивлений RAB/RAC отношением самих отрезков АВ/АС, находим для ЭДС аккумулятора
EAK = EНЭ · AB/AC (48)
Затем устанавливаем ключ в положение 2 (переключаем схему на исследуемый элемент) и определяем точку компенсации/ Предположим это точка C’
Тогда:
ЕАК / RАВ =EНЭ / RАС ’ или EИСЭ = EАК · AC’ / AB (49)
Подставив в это выражение EАК - получаем
EИСЭ = EНЭ · ((AB·AC’) / (AC·AB))
EИСЭ = EНЭ · AC’ / (AC (50)
Т,е, для определения ЭДС исследуемого элемента задача сводится к определению точек компенсации С и C' нормального элемента и исследуемого.
Элемент Вестона является элементом без переноса.
Схема элемента Вестона

 Сd(амальгама) | CdSO4 · 8/3 H2O | CdSO4 | Hg2SO4 | Hg
Сd(амальгама) | CdSO4 · 8/3 H2O | CdSO4 | Hg2SO4 | Hg
Потенциалобразуюшая реакция
Сd + Hg2SO4 D CdSO4 + 2 Hg (51)
Достоинство этого элемента состоит в том, что его ЭДС имеет вполне определенное значение, постоянное во времени и мало меняющееся с температурой EНЭ = 1,0183 В.
Используя компенсационный метод измерения ЭДС можно решить некоторые физико-химические задачи (определить рН раствора, произведение растворимости труднорастворимых соединении, константы диссоциации слабых кислот и т.д)
ОПРЕДЕЛЕНИЕ РН РАСТВОРОВ
а) С помощью двух водных электродов
Составляется следующий гальванический элемент
Pt (H2) | H+ || H+ /(H2) Pt
PH2= 1атм. aH+< 1 aH+= 1 PH2 = 1атм
Пусть правый полуэлемент представляет собой стандартный водородный электрод.
ЭДС этого элемента, согласно уравнению Нернста, равна
E = - R·T/F - ℓnaH+= -2.3R·T/F·ℓgaH+
а учитывая что - ℓnaH+= pH а 2,3RT/F =0,05 (при Т = 298 К) то Е = 0,059pH
pH = E /0.059 (52)
б) С помощью в водородного и хлоросеребряного электродов
Для этого составляется гальванический элемент
|
|
|
Pt (H2) | H+ || KCl | AgCl | Ag
P = 1атм. aH+≠1
Правый полуэлемент (хлорсеребрянный электрод) имеет вполне известный электродный потенциал. ЭДС этого элемента можно представить как
E =φCl- /Ag, AgCl – φ2H+/H2 = φCl- /Ag, AgCl – 0,059∙ℓgaH+
или
E = φCl- /Ag, AgCl + 0,059pH
Отсюда
pH = (E- φCl- /Ag, AgCl)/0.059 (53)
в) С помощью хингидронного электрода
Хингидронный электрод - это окислительно-восстановительный электрод. Он представляет собой платиновый электрод, погруженный в исследуемый раствор, насыщенный хингидроном. (Хингидрон - это эквимольная смесь хинона О6Н4О2 и гидрохинона с6н4(он)2).
Потенциалобразуюшая реакция
С6H4O2 + 2e + 2H+ D С6H4(OH)2 (54)
Потенциал хингидронного электрода определяется выражением
φХ.Г. = φºХ.Г. + 0,059/2∙ℓg (aх·a2H+)/aГ.Х. (55)
В кислых и нейтральных средах активности хинона и гидрохинона равны aх = aГ.Х, тогда
φХ.Г. = φºХ.Г. + 0,059∙ℓg aH+ или (56)
φХ.Г. = φºХ.Г. - 0,059pH (57)
Таким образом, потенциал хингидронного электрода определяется активностью ионов водорода и его можно использовать в качестве индикаторного электрода.
Составим элемент, состоящий их хингидронного и каломельного электродов
Hg | Hg2Cl2 | KCl(насыщ. р-р) || H+(насыщ. х.г.) | Pt
φºХ.Г. =0,699В
φCl- /Hg2Cl2, Hg нас. = 0,2438 В
ЭДС этого элемента
E = φºХ.Г - φCl- /Hg2Cl2, Hg нас.= φºХ.Г. - 0,059pH - φCl- /Hg2Cl2, Hg
Отсюда
pH= (φºХ.Г. - φCl- /Hg2Cl2, Hg – E)/0.059 (58)
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ КИСЛОТЫ ПОТЕЦИОМЕТРИЧЕСКИМ ТИТРОВАНИЕМ
Потенциометрический метод анализа основан на зависимости потенциала электрода от активности ионов в растворе, которая может--изменяться яри протекании в системе различных реакций...
Для проведения потенциометрического титрования необходимо составить гальванический элемент, в котором потенциал одного из электродов должен зависеть от активности ионов исследуемого вещества или титрующего агента. Этот электрод называется индикаторным электродом. Второй электрод в элементе служит электродом сравнения. При добавлении к электролиту индикаторного электрода другого раствора происходит химическая реакция, в результате которой изменяется активность потенциалобразующих ионов, а следовательно и потенциал индикаторного электрода, и ЭДС элемента. При потенциометрическом титровании могут использоваться реакции нейтрализации, осаждения, комплексообразования, а также окислительно-восстановительные реакции»Химические реакции» используемые для потенциометрического титрования, должны удовлетворять следующим требованиям: протекать достаточно быстро, только в одном направлении и возможно полнее»
При реакции нейтрализации в качестве индикаторного электрода используется электрод, потенциал которого является функцией рН раствора (водородный, стеклянный, хингидронный). Электродом сравнения может служить любой электрод, потенциал которого остается постоянным в ходе титрования. Обычно в качестве электродов сравнения используются электроды 11-го рода каломельный или хлорсеребряный.
При определении константы диссоциации слабой кислоты составляется следующий гальванический элемент
Ag | AgCl | KCl |р-р слабой кислоты, насыщ. хингидроном | Pt
Потенциал хингидронного электрода в случае разбавленных растворов связан с концентрацией ионов водорода уравнением
φХ.Г. = φºХ.Г. + 0,059∙ℓgСH+
И ЭДС рассматриваемого гальванического элемента можно представить следующим выражением
φХ.Г. = φºХ.Г. + 0,059∙ ℓgСH+ - φCl- /AgCl, Ag
При титровании слабой кислоты щелочью в системе образуется буферная смесь, т.к. одновременно протекают две реакции: диссоциация слабой кислоты НА. и ее взаимодействие со щелочью:
HA D H+ + A- Kдис. = С H+ · СA- / СHA (59)
HA + NaOH = NaA + H2O (60)
Концентрация ионов водорода в любой момент титрования может быть вычислена следующим образом
С H+ = Kдис. · СHA / СA- (61)
Где
СHA и /СA- -концентрации кислоты и аниона в момент, когда к исходному раствору добавлено Сщ моль/л щелочи.
Концентрацию кислоты выразим через начальную концентрацию, концентрацию ионов водорода и количество добавленной щелочи
СHA = Со, HA – Сщ – С H+ (62)
Концентрацию аниона можно выразить через концентрацию образовавшейся соли, равную количеству добавленной щелочи и концентрацию ионов водорода
СA- = Сщ + С H+ (63)
С учетом этих уравнений концентрацию ионов водорода можно записать
С H+= Kдис. · (Со, HA – Сщ – С H+) / (Сщ + С H+) (64)
В случае титрования слабых кислот
С H+ <<(Со, HA – Сщ) и С H+<< Сщ (65)
С учетом этого концентрация ионов водорода будет равна
С H+ = Kдис· (Со, HA – Сщ)/ Сщ (66)
Подставим это выражение в уравнение для ЭДС. получим
E = φºХ.Г + 0,059ℓg (Kдис· (Со, HA – Сщ)/ Сщ) - φCl- /AgCl, Ag (67)
В момент когда оттитрована половина исходного количества слабой кислоты, т.е. при Сщ = Со, HA ЭДС элемента будет определяться уравнением
E1/2 = φºХ.Г + 0,059ℓg (Kдис· (Со, HA – (С о, HA/2))/ (С о, HA/2) - φCl- /AgCl, Ag = φºХ.Г + 0,059ℓg Kдис - φCl- /AgCl, Ag Откуда,-
ℓg Kдис= - (φºХ.Г - φCl- /AgCl, Ag - E1/2)/0,059 (68)
Таким образом, для определения константы диссоциации необходимо экспериментально определить зависимость ЭДС гальванического элемента от количества прилитой щелочи и построить график. Найти по графику ЭДС элемента, когда оттитрована половина кислоты (E1/2) и подставить это значение
в уравнение (68).
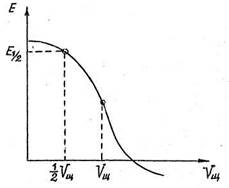
Рис. 4. Зависимость ЭДС гальванического
элемента от объема прилитой щелочи.
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ ИСЛОТЫ
ПУТЕМ ИЗМЕРЕНИЯ рН РАСТВОРОВ
В водных растворах кислот имеет место следующая реакция
HA + H2O D H3O+ +A- (69)
или в упрощенном виде
HA D H+ +A- (70)
В случае слабых кислот константу равновесия реакции, равную константе диссоциации можно представить
Kдис= (CH+ · CA-)/CHA (71)
Если начальную концентрацию кислоты обозначим Со, HA, а равновесную СHA, то
СHA= Со, HA-С H+ (72)
Поскольку С H+ = С A- . выражение для константы диссоциации можно записать
Kдиc= С H+ 2/Со, HA-С H+ (73)
Решая обычное квадратное уравнение,,южно определить концентрацию ионов водорода.
Однако, это уравнение можно упростить. Если кислота диссоциирует слабо, то
С H+<< СHA
тогда выражение для константы диссоциации можно упростить

Проделав простые математические преобразования получим
pH = - 1/2ℓgKдиc- 1/2ℓg Со, HA
или заменив
- 1/2ℓgKдиc=pKдис.
получим
pH = 1/2 pKдис. - 1/2ℓg Со, HA (75)
Это уравнение прямой в координатах “ pH - ℓgСо, HA ”а отрезок, отсекаемый этой прямой на оси ординат, есть
1/2 рКдис
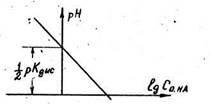
Рис.5. Зависимость рН раствора кислоты от ее концентрации
ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
РАБОТА 1
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 2959; Нарушение авторских прав?; Мы поможем в написании вашей работы!