
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок выполнения работы. 2.4.1 Приготовление стандартных растворов
2.4.1 Приготовление стандартных растворов
Готовят 5 стандартных растворов сахарозы с концентрацией 1, 5, 10, 15, 20%. Для этого рассчитывают, какой объем концентрированного раствора необходимо взять, для приготовления 5 мл растворов с заданной концентрацией. Расчет проводят следующим образом:
Нам необходимо приготовить серию растворов с заданной процентной концентрацией, которая рассчитывается по формуле:
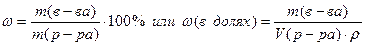 6
6
Так как плотность растворов сахарозы при разбавлении практически не изменяется и примерно равна 1 г/мл, то масса раствора будет численно равна его объему, тогда масса растворенного вещества рассчитывается по формуле:
m(в-ва) = V (р-ра) · ω;
т. к. при разбавлении раствора масса растворенного вещества не изменяется, то:
m(в-ва) = V (р-ра)к · ωк = V (р-ра)р · ωр;
где V (р-ра)к и ωк – объем и массовая доля концентрированного раствора, V (р-ра)р и ωр – объем и массовая доля разбавленного раствора.
Выразим и рассчитаем объем концентрированного 20% раствора сахарозы, необходимого для приготовления 5 мл 1% раствора:
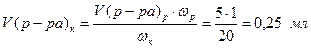
Так же рассчитывают объем концентрированного 20 % раствора сахарозы, необходимый для приготовления оставшихся растворов. В мензурки вносят пипеткой рассчитанный объем стандартного раствора сахарозы и доводят дистиллированной водой до 5 мл.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.4.2 Построение калибровочного графика
Рефрактометр калибруют по дистиллированной воде. Для этого стеклянной палочкой вносят каплю воды в камеру рефрактометра. Добившись совмещения «прицела» прибора с границей темного и светлого полей проводят отсчет по левой шкале рефрактометра. Показатель преломления воды 1,33299. Аналогично измеряют показатель преломления для всех растворов и заносят в таблицу 2:
Таблица 2 – Зависимость показателя преломления растворов сахарозы от концентрации
| С, % | Сх (1) | Сх (2) | Сх (3) | ||||||
| n | 1,33299 |
По данным таблицы строят калибровочный график (рисунок 5):
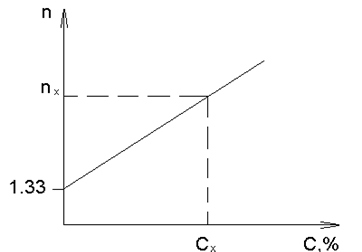
|
| Рисунок 5 – Калибровочный график |
2.4.3 Определение концентрации сахарозы в исследуемом растворе
В цилиндрах приготовлены задачи с неизвестной концентрацией сахарозы. На рефрактометре измеряют показатель преломления задачи nx и по графику определяют концентрацию Сх.
1.___________________________________________________________________________________________________________________________________________2.___________________________________________________________________________________________________________________________________________3.___________________________________________________________________________________________________________________________________________
|
|
Дата добавления: 2015-06-04; Просмотров: 1014; Нарушение авторских прав?; Мы поможем в написании вашей работы!