
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Kb – негіздік иондану константасы. 2 страница
1) Күшті қышқылды күшті сілтімен титрлегенде немесе керісінше болған жағдайда
рТ< 7 болса, сутектік немесе Н+ - қателік;
рТ >7 болса, гидроксидтік немесе ОН- - қателік орын алады.
2) Әлсіз қышқылды күшті сілтімен титрлеу барысында қышқыл толық бейтараптанбай тұрып, индикатор түсін өзгерткендіктен қышқылдық қателік орын алады.
3) Әлсіз негізді күшті қышқылмен титрлеу барысында, әлсіз негіз бейтараптанбай тұрып индикатор түсін өзгерткендіктен, сілтілік қателік орын алады.
Сутектік қателік
Индикатордың титрлеу көрсеткіші рТ, ал кушті қышқылдың нормальді концентрациясы –С1, көлемі – V1 болсын. Титрлеу соңында ерітіндінің көлемі V2 болсын. Титрлеуге алынған сутек иондарының бастапқы эквивалентінің мөлшері n(H+) = C1(H+).V1/1000 Индикатор түсін өзгертетін жағдайға сәйкес келетін сутек иондарының концентрациясы
[H+] = 10-pT.
Титрлеуді аяқтағанда V2 сутек иондарының эквивалентінің мөлшері
n2 = C2(H+).V2/1000 = 10-pT .V2/1000
Титрлеуге дейінгі сутек ионының мөлшері – 100%ал рТ мәніне сәйкес келетін Н+ мөлшері – х % деп сутектік қателік үшін төмендегідей теңдік аламыз:
ΔН+ = 10-pT. V2.100% /C1.V1
Гидроксидтік қателік Күшті сілтіні күшті қышқылмен титрлеу барысында, индикатордың рТ мәнінде, жүйеде сілтінің толық бейтараптанбаунан гидроксидтік қателік туындайды. Титрлеу барысында индикатор түсі рТ мәнінде өзгереді. Осы жағдайға сәйкес келетін гидроксидтік көрсеткіш рОН мәнімен [OH-] тең
pOH = 14 – pT
[OH-] = 10-(14-pT)
Ал гидроксидтік қателік төмендегіше есептелінеді:
ΔOH- = 10-(14-pT).V2.100/C1.V1
Қышқылдық қате  Бұл жағдайда
Бұл жағдайда  қатынасы әлсіз қышқылдың мөлшерін көрсетеді, себебі титрленген қышқыл ерітіндіде А- анионы түрінде жүреді. Егер қышқылдың протолиздену константасын еске алсақ:
қатынасы әлсіз қышқылдың мөлшерін көрсетеді, себебі титрленген қышқыл ерітіндіде А- анионы түрінде жүреді. Егер қышқылдың протолиздену константасын еске алсақ:
 ;
;  ;
; 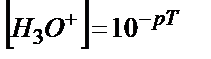 ;
;
 ;
; 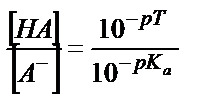

Мысалы, 0,1 М 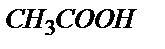 ерітіндісін 0,1М NaOH ерітіндісімен метилді қызыл (рТ=5) индикаторы қатысында титрлесе қышқылдық қате
ерітіндісін 0,1М NaOH ерітіндісімен метилді қызыл (рТ=5) индикаторы қатысында титрлесе қышқылдық қате 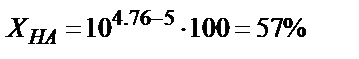 өте үлкен мән. Егер индикатор ретінде фенолфталеинді (рТ=9) пайдаланса,
өте үлкен мән. Егер индикатор ретінде фенолфталеинді (рТ=9) пайдаланса,  . Теңдігін пайдаланып титрлеуге қажетті инликаторды таңдап алуға болады, ол үшін қышқылдық қате өлшеу қатесінен (0,1 %) аспайтындай болу керек, яғни:
. Теңдігін пайдаланып титрлеуге қажетті инликаторды таңдап алуға болады, ол үшін қышқылдық қате өлшеу қатесінен (0,1 %) аспайтындай болу керек, яғни:

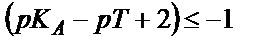 , не
, не 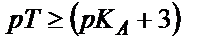
Әлсіз қышқылды титрлегенде индикатор ретінде титрлеу көрсеткіші (рТ) қышқылдық көрсеткіштен (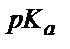 ) ең кем дегенде үш бірлікке артық индикаторды алу керек. Қышқылдық қате сияқты негіздік қатені былай есептеуге болады:
) ең кем дегенде үш бірлікке артық индикаторды алу керек. Қышқылдық қате сияқты негіздік қатені былай есептеуге болады:  пайдаланатын индикатордың титрлеу көрсеткіші
пайдаланатын индикатордың титрлеу көрсеткіші 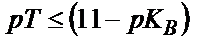 болу керек.
болу керек.
19. Гравиметрлік талдау әдісінің мәні және оны қолдану шектері. Гравиметрияда қатты фаза түзілуінің механизмін жазып көрсетіңіз. Гравиметрлік әдіс дегеніміз анықталынатын заттың құрамы тұрақты қатты фаза күйінде бөліп, массасын дәл өлшеуге негізделген сандық анализдің бір түрі. Гравиметрлік талдаудың аналитикалық сигналы – масса. Химиялық анализдердің ішінде гравиметрлік әдіс ең дәл тәсілдердің біріне жатады: оның дұрыстығы – 0,1-0,2%, ал анықтау шегі 0,1%. Гравиметрлік әдісте алмасу, орын басу, ыдырау, комплекс түзу реакциялары пайдаланады және бұл әдіс келесі химия заңдарына негізделеді: құрам тұрақтылық заңына; химиялық эквивалент заңына; масса сақталу заңына.Гравиметрлік анықтаудың дәлдігі жоғары болу үшін ірі кристалдық, ерігіштігі төмен, өзі таза, жақсы сүзілетін тұнба алынуы қажет.Тұнбаның қасиеті көбінесе тұнбаның пайда болу механизмінің екі сатысымен анықталады. Ол: 1. кристалдану орталықтар пайда болуы. 2. пайда болған орталықтардың өсуі.Жаңадан пайда болған бөлшектердің мөлшері осы екі сатының қайсысы басым болатына байланысты. Егер тұну бірінші жолмен жүрсе, тұнба өте ұсақ бөлшектерден тұрады; егер екінші жол басым болса – ірі кристалды тұнба алынады. Сапалық түрде қандай тұнба түзілетіні көрсететін Веймарн ұсынған салыстырмалы асақанығу деген ұғым (СА)пайдаланылады.

Бұл ереже бойынша тұнба түзілу барысында тұнба бөлшектерінің шамасы мен салыстырмалы аса қанығу арасында кері пропорционалдық байқалады:
СА – салыстырмалы аса қанығу;
S – тепе-теңдік күйдегі тұнбаның ерігіштігі, моль/л
G – тұнба түзетін ерітінділерді бір-біріне қосқанда ерітінділердің бастапқы мольдік концентрациясы.
Кристалдану орталықтарының түзілу жылдамдығы мен I-ші және II-ші механизмдердідің жылдамдықтары мен салыстырмалы аса қанығудың арасындағы тәуелділік экспоненциалдық заңдылыққа бағынады. Ал кристалдық орталықтарының өсу жылдамдығы мен аса қанығудың арасындағы тәуелділік тура сызықты.Кристалдық тұнбаларды алу үшін тұндыруды жоғары температурада (S↑), сұйытылған ерітіндіден (G↓) жүргізеді. Және тұндырғышты тамшылатып, араластыра отырып қосады (G↓). Керісінше жағдайда амарфты тұнба түзіледі.
20. Кристалды және аморфтық тұнбалар, оларды алу жағдайлары. Түнбалардың ластану түрлерін атаңыз. Кристалдық және аморфты тұнбалар түзілу жағдайлары.
1. сұйытылған ерітінділерге тұндырғыштың сұйытылған ерітіндісін қосу керек.
2. тұндырғышты баяу, тамшылатып қосады.
3. ерітіндіні шыны таяқшамен үнемі араластырыптұру қажет (тамызған жерде СА азайту үшін).
4. тұндыруды ыстық ерітінділерден ыстық тұндырғышпен жүргізеді. Жоғары температурада ұсақ кристалдар ериді де, ірі кристалдық тұнба түзілуіне мүмкіндік туады.
5. ерігіштікті жоғарылататын жағдай жасау (рН, комплекс түзуші реагент).
6. тұндырғышты 1,5-2 есе артық мөлшерде қосады.
7. тұнбаны жетілдіру үшін оны тұндырылған ыдыста 24 сағатқа қалдырады (қайта кристалдану).
Амофты тұнбалар түзілу жағдайлары:
1. тұндыруды концентрлі реагенттермен жүргізеді. Бұл кезде адсорбция төмендейді.
2. тұндыруды жоғары температурада жүргізеді.
3. ерітіндіні үнемі араластырып тұру қажет
4. коагулятор (электролит) қатысында жүргізеді.
5. тұндырғыш қосып болған соң, тұнба мен ерітіндіге (100 мл) ыстық су қосып, араластырып, бірден сүзіп алады (тұнбаны ерітіндімен бірге ұзақ уақытқа қалдыруға болмайды).
Коллоидты бөлшектердің бір-бірімен қосылмай ерітіндіде жүруінің бір себебі – бөлшектердің аттас электрлік зарядпен зарядталғандығында. Бөлшектер бір-бірімен тебіседі де ірі агрегаттар түзбейді. Зарядталудың себебі мысалы сульфидтердің кристалдық орталықтары ерітіндіден катиондарды немесе аниондарды адсорбциялайды:
{[As2S3]m·n HS-·(n-x)H+}x-
крист.орта
зарядталған бөлшек
{[AgJ]m·nAg+·(n-x)NO3-}x+
зарядталған бөлшек
Коллоидты ерітінділердегі бөлшектерді ірілету – коагуляция деп аталады. Тағы бір клагуляцияның әдісі – күшті электролиттердің концентрациясын арттыру. Бұл жағдайда коллоидты бөлшектердің зарядтары кеміді, сондықтан олардың бір-бірімен қосылу қабілеттігі өседі. Коагуляцияланған тұнба аморфты тұнба деп аталады. Бұл тұнба ұсақ бөлшектерден тұратындықтан, оның беттік қабаты үлкен болады. Ал беттік ауданы үлкен бөлшектер бөгде иондарды адсобциялап, оңай ластанады.Тұнба түзілу нәтижесінде тұнбаның құрамында бөгде қосылыстар болуы мүмкін. Қосарлана тұнбаға түсу процестерінің табиғаты әр түрлі болуы мүмкін, олардың ең негізгілері:
- иондардың беттік адсобциясы
- окклюзия
- изоморфты қосылыстар түзу
- кейіннен тұнбаға түсу
Тұнба бетінде бөгде иондардың (молекулалардың) концентрленуі (адсорбция) 4 негізгі жағдайға тәуелді:
- Панет-Фаянс-Ган заңы.
Егер ерітіндідегі барлық иондардың концентрациялары бірдей болғанда, кристалдық торға тұнбаның құрамына кіретін бір ионымен нашар еритін қосылыс түзетін ион бірінші адсорбцияланады.
- Адсорбция концентрацияға тәуелді. Тұнбаның үстіндегі ерітіндіде қандай ионның концентрациясы жоғары, сол ионның адсорбциясы басым болады, сонымен қатар, кез келген ионның адсобциялануы оның концентрациясына тура пропорционал.
- Адсорбция зарядқа тәуелді, себебі ерітіндідегі иондар заряды мен криста бетінде орналасқан орталықтар арасындағы электростатикалық тартылыс күштірек болады.
- Адсорбцияланатын ионның шамасына иондық радиусы әсер етеді. Тұнба түзуші ионмен иондық радиустары ұқсас иондар тұнба бетінде жақсы адсобцияланады.
Тұнбаның ластануын болдырмау үшін мына шаралар қолданылады:
1. Тұндыруды сұйытылған ерітінділерде жүргізеді,бұл кезде бөгде компоненттердің концентрациясы негізгі компоненттің концентрациясынан салыстырмалы төмен болады.
2. Ірі кристалдық тұнба алынатын шарттарды қолдану.
3. Ерітіндідегі барлық компоненттердің ерігіштігін жоғарлату үшін, және коллоидты ерітінділедің түзілуін болдырмау үшін тұндыруды ыстық ерітінділермен орындау қажет.
4. тұнба бетінде жақсы адсорбцияланатын жоғары зарядты иондарды төмен зарядты иондарға ауыстыру.
5. тұндырғышты дұрыс таңдау керек, яғни тұнбамыз бөгде компоненттермен нашар еритін қосылыс түзбеу қажет.
Тұнбаның ластануы.
Тұнбаның ластануының енді бір түрі – окклюзия. Окклюзия дегеніміз тұнба түзілу кезінде бөгде иондарды бірге ала кету. Кристалдық тордың ішінде адсобцияланған қоспалар болуы мүмкін (ішкі адсобция), екіншіден тор қуыстарында ерітінді қалып қалу (инклюзия).
Ерітінділерді қосу ретіне байланысты окклюзияның әсерін азайтуға болады:
- Ba2+ + H2SO4 → BaSO4 · Ba2+/Cl- (барий хлориді окклюзияға ұшырайды, ол өте ауыр, қателік жоғары)
- H2SO4 + Ba2+ → BaSO4 · SO4-/H+ (күкірт қышқылы окклюзиясы, қателік азаяды)
Изоморфты кристалдану (қатты ерітінділер) – тұнба ластанудың түрі.
Кристалдық тордың түйіндерінде негізгі тұнбаның иондары басқа иондармен алмасады:
- иондық радиустары жақын иондар
- зарядтары бірдей
- кристалл пішіндері бірдей
Кейіннен тұнбаға түсу себебінен тұнбаның ластануы. Алғашқы алған таза тұнбаны сол ерітіндіде қалдырса, ол басқа заттың соңынан тұнуы нәтижесінде ластануы мүмкін. Мысалы, CaC2O4-тың Mg2+ бар ерітіндіден тұндырса, алашқыда таза CaC2O4 тұнбасы түседі. Егер осы тұнбаны ерітіндіде қалдырса, оның үстіне бірте-бірте MgC2O4 тұна бастайды. Тұнбаның беткі қабатында тұндырғыштың әжептәуір мөлшері адсорбцияланады, сондықтан оның концентрациясы артады. Осының нәтижесінде тұнбаның бетінде екінші заттың иондарының ИК>КS0 артады да, оның тұнбаға түсу жағдайы пайда болады. Сондықтан тұнба мен ерітіндінің жанасу уақытын азайту керек.
21. Комплексонометрлік титрлеу әдісінің мәні. Комплексондар, олардың ерекшеліктері, эквиваленттері, сутек иондарының әсері. Мысал келтіріп жазыңыз.
Комплексометриялық әдісте анықталынатын зат пен титрант арасында комплексті қосылыс түзілу реакциясы пайдаланады. Комплексометриялық титрлеу әдісте пайдаланылатын реакцияларға титриметриялық анализде реакцияларға қойылатын шарттар қойлады. Ең негізгісі – реакция нәтижесінде белгілі стехиометриялық құрамға сәйкес қосылыс түзілу керек. Комплексонометриялық титрлеу әдістері органикалық титранттарды, швейцар химигі Шварценбах ұсынған аминополикрабон қышқылдарын металл иондарын анықиауға пайдаланды. Мысалы аминополикарбон қышқылдары комплексондар, ал оларды пайдаланып титрлеу комплексонометриялық титрлеу д.а. Комплексондардың ең қарапайым өкілдері: иминодисірке қышқылы – HN(CH2COOH)2, нитрилоүшсірке қышқылы – N(CH2COOH)3, этилендиаминтөртсірке қышқылы – ЭДТА (HOOCH2C)2N-CH2-CH2-N(CH2COOH)2. ЭДТА – ның екі натрийлы тұзы трилон Б деп аталады. ЭДТА су ерітіндісінде карбоксил топшаларындағы төрт протонның беріп ионданады. Егер оны H4J деп жазатын болса, келесі протолитикалық тепе-теңдікте орын алады. ЭДТА- ның формуласын H2[H2J] түрінде жазуға болады, ал оның тұзын – Na2H2J, ол төрт негізді әлсіз қышқылдың тұзы. Судағы ерітіндісінде келесі тепе-теңдіктер орын алады:
Н4У ↔ Н+ + Н3У- Ка1 =1.10-2
Н3У-↔ Н+ + Н2У2- Ка2 =2,1.10-3
Н2У2-↔ Н+ + НУ3- Ка3 =6,9.10-7
НУ3- ↔ Н+ + У4- Ка4 =5,5.10-11
Сондықтан ерітіндінің рН-на байланысты иондардың мольдік улестері (α) өзгеріп отырады. ЭДТА координациялық саны 4,6 және одан да көп металл иондарының координациялық сферасын түгел толтырады. Пайда болған комплекстің құрамы метал-ионының зарядына тәуелсіз M:L = 1:1 болып табылады.Метал иондырының зарядтарына тәелсіз Na2ЭДТА мен комплекстүзу реакция теңдеуі бірдей жазылады:
Mn+ + Y4- = MYn-4 β = 
Комплексондар көпдентатты болғандықтан метал-иондарымен хелатты циклдар түзеді. Хелатты циклдердің саны артқан сайын комплекстік қосылыстың тұрақтылығы да артады. ЭДТА метал иондарымен комплекс түзген кезде әр метал иондары әрекеттескенде ерітіндіге екі Н+ протон бөлініп шығады. Сондықтан буферлі ерітінділер пайдаланылады, мысалы аммиакты буфер ерітіндісі. Ал аммиак көптеген металдардың өзі де комплекс түзеді, сол себептен термодинамикалық βМУ орнына β/МУ – шартты тұрақтылық константасын қолданамыз. Y4- нің мольдік үлесі  ескерсек,
ескерсек, 
Cонда 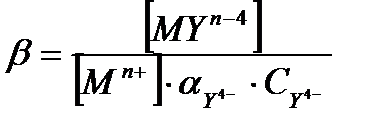 , ал
, ал 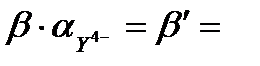

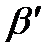 - шартты тұрақтылық константа, ол ерітіндінің рН-на тәуелді өзгеріп отырады. Сондықтан αУ рН-қа байланысты өзгереді. Қышқыл ортада αУ мәні өте азаяды. Осы себептен Cd2+, Mg2+, Sr2+ иондарын комплексонометриялық әдіспен негіздік ортада анықтайды, ал өте тұрақты комплекс түзетін иондарды (Bi3+, Fe3+) қышқылдық ортада титрлеуге болады. Комплексонометриялық титрлеудің дәлдігі жоғары болу үшін β/МУ мәні ≥107 сәйкес болу керек.
- шартты тұрақтылық константа, ол ерітіндінің рН-на тәуелді өзгеріп отырады. Сондықтан αУ рН-қа байланысты өзгереді. Қышқыл ортада αУ мәні өте азаяды. Осы себептен Cd2+, Mg2+, Sr2+ иондарын комплексонометриялық әдіспен негіздік ортада анықтайды, ал өте тұрақты комплекс түзетін иондарды (Bi3+, Fe3+) қышқылдық ортада титрлеуге болады. Комплексонометриялық титрлеудің дәлдігі жоғары болу үшін β/МУ мәні ≥107 сәйкес болу керек.
22. Қышқыл негіздік титрлеу индикаторлары, индикаторлық көрсеткіші, индикаторлардың түсі ауысу аралығын анықтау.
Титрлеуге қажетті индикаторды таңдау. Бейтараптану реакциялары жүрген кезде сырттан көрінетін өзгерістер байқалмайды. Сондықтан эквиваленттік нүктені анықтау үшін тиісті индикаторлар қолданады (рН индикаторлар). Индикаторлар негізгі реакция бітісімен жүйе түсін өзгертеді немесе өзге түрде хабар сездіреді (мысалы: тұнба түзіледі). Индикатордың диссоциациялануын сипаттайтын константа КInd және индикатор көрсеткіші pKInd өз ара байланыста болады. Индикаторлар қышқылды-негіздік, тотығу-тотықсыздану, комплекс түзу, адсорбциялық және арнаулы (спецификалық) болып бөлінеді. Қышқылды-негіздік индикаторлар суда әлсіз протолиттік қасиет көрсететін органикалық қышқылдар мен негіздер. Әрекеттесуші заттарға қарағанда бұл индикаторлар өте әлсіз қышқылдық немесе негіздік қасиет көрсететіндіктен, олардың түсінің өзгеруі белгілі бір рН мәнінде ғана орын алады.Индикатордың ионизацияланбаған түрінің түсі мен ион түріндегі бөлшектерінің түсінің арасында айырмашылық болады. Егер 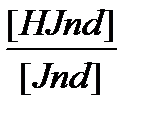 қатынасы бірге тең болса рКА = рН + lg1 = pH = pT титрлеу көрсеткіші деп аталады. Яғни, титрлеу көрсеткіші индикатордың екі түрі бір-біріне тең жағдайда сәйкес рН-пен анықталады. Индикатор өзінің түсін рН = pKJnd ± 1 аралығында өзгертеді. Егер, жүйенің сутектік көрсеткіші рН ˂ рКInd – 1 болса, онда ерітіндінің түсі индикатордың қышқылдық түрімен анықталады. рН ˂ рКInd + 1. Бұл рН аралығын индикатордың түсін ауыстыру аралығы деп атайды.Көп қолданыс табатын қышқылды-негіздік индикаторларға келесі индикаторлар жатады: метил қызылы, метил қызғылт-сарысы, лакмус, фенолфтфлеин, фенол қызылы, тимолфталеин.Органикалық заттардың түстері олардың құрамындағы ерекше атомдар топтары «хромофорлар» (түс көрсеткіш зат) болуынан байқалады.түстердің интенсивтілігін ауксохромдартоптары әсер етеді (күшейтеді). Ионды – хромофорлы теория қағидалары бойынша ерітінділердің рН-мәнінің өзгеруіне байланысты, молекула ішінде атомдардың қайта топтануы жүреді. Бұл атомдардың қайта топтануы қайтымды процесс және таутомерлік изомерия деп аталады.Қышқылды-негіздік индикаторлар келесі талаптарға жауап беруі тиіс:
қатынасы бірге тең болса рКА = рН + lg1 = pH = pT титрлеу көрсеткіші деп аталады. Яғни, титрлеу көрсеткіші индикатордың екі түрі бір-біріне тең жағдайда сәйкес рН-пен анықталады. Индикатор өзінің түсін рН = pKJnd ± 1 аралығында өзгертеді. Егер, жүйенің сутектік көрсеткіші рН ˂ рКInd – 1 болса, онда ерітіндінің түсі индикатордың қышқылдық түрімен анықталады. рН ˂ рКInd + 1. Бұл рН аралығын индикатордың түсін ауыстыру аралығы деп атайды.Көп қолданыс табатын қышқылды-негіздік индикаторларға келесі индикаторлар жатады: метил қызылы, метил қызғылт-сарысы, лакмус, фенолфтфлеин, фенол қызылы, тимолфталеин.Органикалық заттардың түстері олардың құрамындағы ерекше атомдар топтары «хромофорлар» (түс көрсеткіш зат) болуынан байқалады.түстердің интенсивтілігін ауксохромдартоптары әсер етеді (күшейтеді). Ионды – хромофорлы теория қағидалары бойынша ерітінділердің рН-мәнінің өзгеруіне байланысты, молекула ішінде атомдардың қайта топтануы жүреді. Бұл атомдардың қайта топтануы қайтымды процесс және таутомерлік изомерия деп аталады.Қышқылды-негіздік индикаторлар келесі талаптарға жауап беруі тиіс:
- өте сезімтал
- түсі анық және қанық болуы шарт
- ерітінді түсін өзгертетін рН мәнінін аралығы жақын
Егер титрлеуде индикатор дұрыс таңдалмаса титрлеудің индикаторлы қателігі өте жоғары болуы мүмкін.
23. Потенциометрлік титрлеу әдісінде эквивалентті нүктені әртүрлі графикалық тәсілдермен анықтау.
Эквивалентті нүктені анықтау үшін әр-түрлі графикалық тәуелділіктерді қолданады: интегралды, дифференциалды, дифференциалдың екінші туындысы бойынша, Гран әдісі. Потенциометрлік титрлеу Эквиваленттік нүктені табуға негізделген титрлеу реакциясыпа қатынасқан қосылыстың тек біреуі ғана электродты құбылыска араласатын болғанда, эквиваленттік нұктенің маңында индикаторлы электродтың потенциалы өзгереді. Айталық кышқылды - негізді әдіс бойынша титрлегенде, шыны электродын хлоридті хлор-күміс арқылы жүзеге асырады. Мұндағы реакциялар тез өтіп, соңына дейін толық жүреді. Жалпы потенциометрлік титрлеуді жүргізу үшін талданатын ерітіндідегі индикаторлы электрод пен салыстыру электродынан тұратын тізбекті жинақтайды.
Соңғы нүктені анықтау. Суретте титрлеу кисықтары мысал ретінде келтірілген.
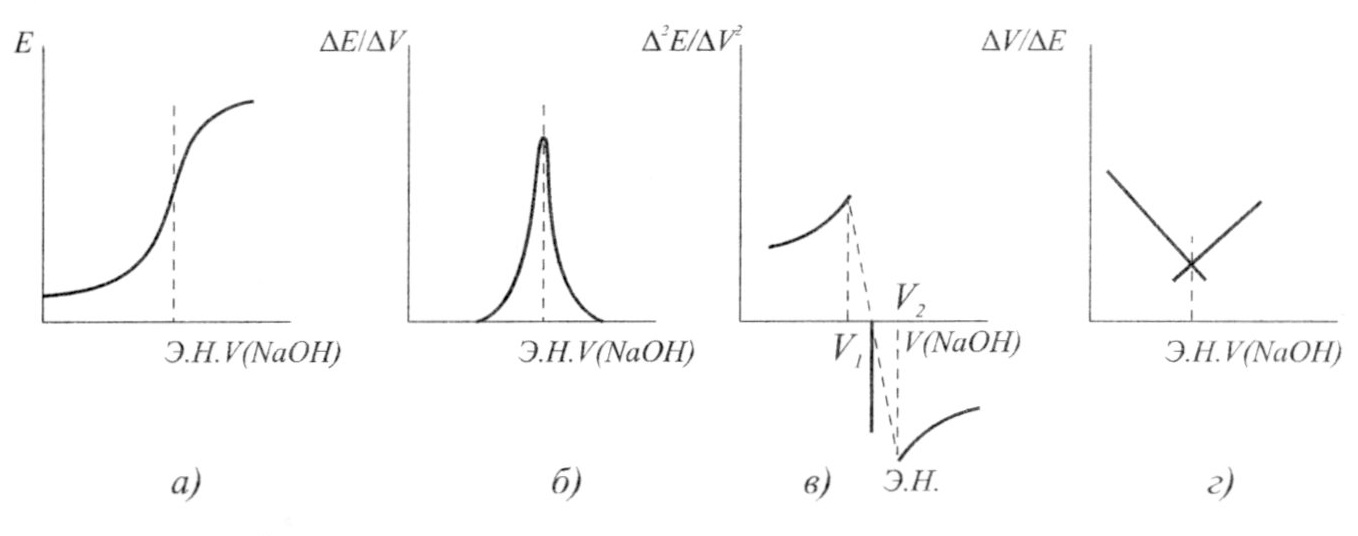
Осы суретте (а) тұз қышқылын калий гидроксидімен, яғни күшті қышқылды күшті негізбен титрлеудің қисығын теориялық тұрғыдан кескінделген. Мұндағы эквивалент нүкте индикаторлы электрод потенциалының кенеттен секіруіне байланысты. Бұл секіру эквивалент нүктені анықтайды, осыған қарап талданатын ерітінді құрамындағы қышқыл концентрациясы есептелінеді.
Екінші (б) суретте эквивалентті нүктені табу үшін AE/Av - V координатында дифференциалды қисық сызылады, ал абсцисса өсіндегі есептеу титрант көлемін көрсетеді. Дифференциалды қисық көмегімен эквивалент нүктені нақтылы тауып, дәл есептеуге болады.

мұндағы СK және CX - қалыпты және зерттелінетін ерігінділердін концентрациясы, γK және γX - олардың активтілік коэффициенттері.
Егер осы екі ерітіндінің құрамы мен иондық күші шамамен бірдей болса, онда олардың белсенділік коэффициенттері не өзара тең, не шамалас мэнде болады. Сонда:
 Е = 0 болса, СK= СX, өйткені Ig СK/СX = 0. ал СK/СX = 1. Е = 0 шарт орындалу үшін, қалыпты ерітіндіге қалқалаушы, ягни арнаулы электролит қосса болғаны.
Е = 0 болса, СK= СX, өйткені Ig СK/СX = 0. ал СK/СX = 1. Е = 0 шарт орындалу үшін, қалыпты ерітіндіге қалқалаушы, ягни арнаулы электролит қосса болғаны.
Бұл ретте зерттелінетін ерітіндіге сұйылтқыштың немесе қалыпты ерітіндінің бірнеше пропорционал бөлігін қосып, әрбір қосқаннан кейінгі ЭҚК өлшейді де, осы молімет бойынша Е - lgCK координатындағы титрлеу қисық сызығы салынады. Осы сызықтың абсцисса өсімен киылысқан нүктесі Е = 0 сэйкес және ондайда СK= СX.
24. Амперметрлік титрлеу әдісін талдауда қолдану.
Амперометриялық титрлеу әдісі бұны анализдің титрлеу әдісі деп немесе полярогографиялық әдістің бір түрі деп айтса болады. Амперпометриялық әдіс ток күшінің еретендідегі электрохимиялық реакцияға қатысатын иондар концентрациясына тәуелділігіне негізделген. Амперпометриялық титрлеуде әртүрлі реакциялар қолданылады: 1. Тұндыру реакциялары мысалы калий ферроцианидімен титрлеу. 2. Тт тсзд реакциясы мысалы ванадат иондарын екі валентті темір иондарымен титрлеу. 3. Комплекс түзу реакциялары, мысалы Са2+ ионын натрий ЭДТА ерітіндісімен титрлеу. Амперометриялық әдісте электрохимиялық реакцияға анықталатын реагент пен титранттың біреуінің қатысуы жеткілікті. Осыған байланысты әртүрлі титрлеу қисықтарын алуға болады. Егер электрохимиялық реакцияға анықталатын ион қатысатын болса титрант қосқан кезде тұнба немесе нашар диссоциацияланатын заттар түзіліп анықталатын зат конц кемиді. Осыған байланысты I- күші де кемиді, мысалы Pb2++H2SO4=>PbSO4 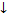 +2H+. Анықталатын ион электродта тт тсзд реакциясына қатыспайтын жағдайда электродта тотығып немесе тсзд титрант қолданылады: 3Zn2++2K4[Fe(CN)6]=>K2Zn3[Fe(CN)6]2
+2H+. Анықталатын ион электродта тт тсзд реакциясына қатыспайтын жағдайда электродта тотығып немесе тсзд титрант қолданылады: 3Zn2++2K4[Fe(CN)6]=>K2Zn3[Fe(CN)6]2 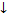 +6K+. Кейде анықталатын ион да, титрант та электрохимиялық реакцияға қатысуы мүмкін. Бұндай жағдайда ток күші алдымен кемиді де, эквиваленттік нүктеден кейін ток күші қайтадан өсе бастайды. Мысалы: Pb2++CrO42-=>PbCrO4
+6K+. Кейде анықталатын ион да, титрант та электрохимиялық реакцияға қатысуы мүмкін. Бұндай жағдайда ток күші алдымен кемиді де, эквиваленттік нүктеден кейін ток күші қайтадан өсе бастайды. Мысалы: Pb2++CrO42-=>PbCrO4 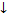
|
|
Дата добавления: 2015-06-04; Просмотров: 2572; Нарушение авторских прав?; Мы поможем в написании вашей работы!