
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Kb – негіздік иондану константасы. 3 страница
|
|
|
|
25. Амперметрлік титрлеу қисықтарының түрлері. Анықтауларға мысалдар келтіріп жазыңыз.
26. Салыстырмалы электродтар, олардың түрлері мен потенциалдары. Электродтық реакцияларын жазып, потенциалдары не себептен тұрақты болатынын түсіндіріңіз. Салыстырмалы электродтар деп белгілі жағдайда потенциалы белгілі, тұрақты және ерітінді құрамына тәуелсіз (қайтымды) электродтарды айтады. Салыстырмалы электрод ретінде сутекті электрод қолданылады. Түрлі электродтардың потенциалының абсолюттік шамасын анықтауға мүмкіндік болмағандықтан, стандартты сутекті электрод потенциалы шартты түрде нольге тең деп алынады. Нормальды сутекті электрод 1 атм. қысымда газды сутек жіберілетін және сутек иондарының концентрациясы 1 моль/л тең H2SO4 ерітіндісіне батырылған арнайы өңделген (платинирленген) платина пластинкасынан тұрады. Сутекті электродтың сызба-нұсқасы:
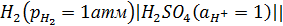
Жүйедегі электродтық реакция теңдігі:
2H++2e↔H2
Қайтымды электродтық потенциалы:
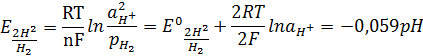
 – газды сутектің парциал қысымы
– газды сутектің парциал қысымы
Тәжірибелік жұмыстарда сутекті электродты пайдалануға ыңғайсыз, сондықта күміс-хлоридті, каломельді, меркур-иодидті электодтарды пайдаланылады. Олардың электродтық потенциалдары жоғары болуы керек. Каломельді электрод – металдық сынап, құрамында H2Cl2 тұнбасы бар KCl-дың белгілі концентрациялы ерітіндісінен тұрады.
||Hg2Cl2 (қан.),KCl(x)|Hg x-мольдік концентрация
Hg2Cl2 + 2е ↔ 2Hg+ + 2Cl-
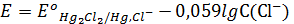
Жүйедегі хлорид-иондарының концентрациясы тұрақты болғандықтан жүйе потенциалы да тұрақты болады. Егерде  = 1, онда
= 1, онда
|
|
|

(нормальды сутек электродымен салыстырғанда) Күмісхлоридті электрод – AgCl тұнбасымен қапталған және КСІ ерітіндісіне батырылған күміс электродынан тұрады.
||AgCl (қан), KCl (x)|Ag
AgClқан + е ↔ Ag0+Cl-

Потенциалы нормальды сутек электродымен салыстырғанда,

27. Спектрофотометрия әдісін талдауда қолдану. Бугер Ламберт Бер заңы. Оптикалық тығыздық және молярлық жұту коэффициенті. Спектроскопия кванттық теорияға негізделеді. Бұл теория бойынша зат бөлшектрі (атомдар, молекулалар) белгілі ғана стационарлы күйлерде бола алады. Әр күйге белгілі энергия деңгейі сәйкес келеді. Минимльды энергия деңгейі сәйкес келетін зат күйін негізгі энергетикалық күйі дейді, ал қалған күйлер – қозған деп аталады. Бір стационарлы күйден екіншіге ауысқанда зат бөлшектері энергияны шығарады немесе сіңіреді.Ол келесі теңдеумен анықталады: 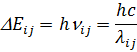 DE-деңгейлерге ауысу энергиясы,В
DE-деңгейлерге ауысу энергиясы,В
h-Планк тұрақтысы
n-жиілік,Гц
λ-толқын ұзындығы, нм
c-жарық жылдамдығы,м/с
Спектроскопияда көбінесе молекуланың электромагниттік өрістің әсерінен қозуын қолданады. Бұл кезде молекула фотонды жұтады, фотонның энергиясы оның орбитальдарының энергиялар айырымына тең болады.Мысалы, төртбұрышты кюветаны тең қабаттарға бөлсек, әр қабат жұтатын жарықтың үлесі бірдей болады. Жарық бірінші қабаттан өткенде n есе әлсірейді.  ;
; 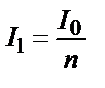 Бірінші қабаттан өткен жарық I1 екінші қабатқа түседі де, қалыңдығы бірдей болғандықтан, ол да n есе әлсіреп өтеді:
Бірінші қабаттан өткен жарық I1 екінші қабатқа түседі де, қалыңдығы бірдей болғандықтан, ол да n есе әлсіреп өтеді:
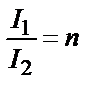 ;
;  . Енді I1 орнына оның өз мәнін қойсақ:
. Енді I1 орнына оның өз мәнін қойсақ: 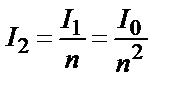 .
.
Сол сияқты 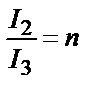 ;
; 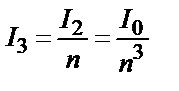 .
.
Қалыңдығы l қабаттан өткен жарықтың I мөлшері: 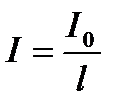 ;
;  ;
; 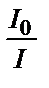 қатынасының ондық логарифмі ерітіндінің оптикалық тығыздығы деп аталады, ол А(D) белгіленеді:
қатынасының ондық логарифмі ерітіндінің оптикалық тығыздығы деп аталады, ол А(D) белгіленеді:  . Ламберт-Бугер заңы бойынша жарықтың жұтылған мөлшері боялған ерітіндінің қалыңдығына тікелей байланысты.Жоғарыда айтылған тәсіл Ламберт-Бугер заңын геометриялық жолмен қорытып шығару әдісі. Математикалық жолмен Ламберт-Бугер заңы экспоненциалды байланысты көрсететін теңдікпен өрнектеледі:
. Ламберт-Бугер заңы бойынша жарықтың жұтылған мөлшері боялған ерітіндінің қалыңдығына тікелей байланысты.Жоғарыда айтылған тәсіл Ламберт-Бугер заңын геометриялық жолмен қорытып шығару әдісі. Математикалық жолмен Ламберт-Бугер заңы экспоненциалды байланысты көрсететін теңдікпен өрнектеледі: 
|
|
|
е – натурал логарифмнің негізі;
К1 – жұтылу коэффициенті;
l – жарық жұтатын қабаттың қалыңдығы;
I/ I0 – қатынасын өткізгіштік деп атайды да Т деп белгілейді.
(1) – теңдіктің логарифмді түрін жазсақ:  . Енді натурал логарифмді ондық логарифмге айналдырсақ:
. Енді натурал логарифмді ондық логарифмге айналдырсақ: 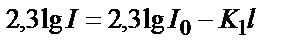 . Осы теңдеуді өзгерте отырып мынадай теңдік алуға болады:
. Осы теңдеуді өзгерте отырып мынадай теңдік алуға болады: 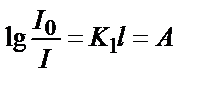 . Сонда
. Сонда  . Яғни,
. Яғни,  . Оптикалық тығыздық пен өткізгіштік арасындағы байланыс:
. Оптикалық тығыздық пен өткізгіштік арасындағы байланыс:  . Жарық жұтатын заттың концентрациясы (С) мен оптикалық тығыздықтың (А) арасындағы байланыс Бер заңымен анықталады. Бұл заң бойынша ерітіндінің қалыңдығы тұрақты болса оптикалық тығыздықтың мәні ерітіндінің концентрациясына тура пропорционалды:
. Жарық жұтатын заттың концентрациясы (С) мен оптикалық тығыздықтың (А) арасындағы байланыс Бер заңымен анықталады. Бұл заң бойынша ерітіндінің қалыңдығы тұрақты болса оптикалық тығыздықтың мәні ерітіндінің концентрациясына тура пропорционалды: 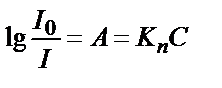 .
.
Бұндағы, Kn – пропорционалдық коэффициенті; С – анықталатын заттың концентрациясы. Боялған ерітіндінің бойынан өткен монохроматты жарық шоғының интенсивтігі (I), түскен жарық шоғының интенсивтігі (I0), боялған қосылыстың концентрациясы (С) және ерітіндінің қалыңды (l) арасындағы байланысты жалпы Бугер-Ламберт-Бер заңымен өрнектейді:  K – жарықжұту коэффициенті. Бұл мән 1) еріген заттың табиғатына; 2) температураға; 3) еріткішке және 4) жарық толқынының ұзындығына байланысты. Егер С=1 моль/л; l = 1см болса, онда (K) – молярлы жарық жұту коэффициенті деп аталады да,
K – жарықжұту коэффициенті. Бұл мән 1) еріген заттың табиғатына; 2) температураға; 3) еріткішке және 4) жарық толқынының ұзындығына байланысты. Егер С=1 моль/л; l = 1см болса, онда (K) – молярлы жарық жұту коэффициенті деп аталады да,  деп белгіленеді. Молярлы жарық жұту коэффициенті деп қалыңдығы 1см кюветадағы 1М ерітіндінің оптикалық тығыздығын айтады, оны
деп белгіленеді. Молярлы жарық жұту коэффициенті деп қалыңдығы 1см кюветадағы 1М ерітіндінің оптикалық тығыздығын айтады, оны  -деп белгілейді.
-деп белгілейді.  - ерітіндінің қалыңдығы мен концентпрациясына тәуелді емес, ол боялған қосылыстың табиғатын көрсетеді. Бұл кезде
- ерітіндінің қалыңдығы мен концентпрациясына тәуелді емес, ол боялған қосылыстың табиғатын көрсетеді. Бұл кезде 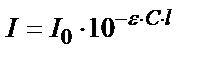 . Жарық жұтудың негізгі заңы толық сақталғанда ерітіндінің оптикалық тығыздығы (А) молярлы жарық жұту коэффициентіне, жарық жұтатын заттың концентрациясына және ерітіндінің калыңдығына тікелей тәуелді:
. Жарық жұтудың негізгі заңы толық сақталғанда ерітіндінің оптикалық тығыздығы (А) молярлы жарық жұту коэффициентіне, жарық жұтатын заттың концентрациясына және ерітіндінің калыңдығына тікелей тәуелді: 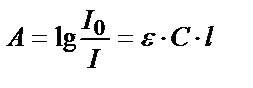 Молярлы жарық жұту коэффициентінің теориялық мәні
Молярлы жарық жұту коэффициентінің теориялық мәні  . Бугер-Ламберт-Бер заңын қолданып анықтайтын заттың анықталу шегін (Смин) табуға болады. (3) – теңдіктен
. Бугер-Ламберт-Бер заңын қолданып анықтайтын заттың анықталу шегін (Смин) табуға болады. (3) – теңдіктен 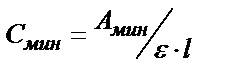 . Егер l = 1см болса және А=0,005 болса, онда
. Егер l = 1см болса және А=0,005 болса, онда  Егер заттың анықтау шегін одан әрі азайту қажет болса ерітіндінің қалыңдығын көбейту керек.
Егер заттың анықтау шегін одан әрі азайту қажет болса ерітіндінің қалыңдығын көбейту керек.
|
|
|
Бугер-Ламберт-Бер заңы белгілі жағдайда сұйытылған ерітінділер үшін әділетті. Бугер-Ламберт-Бер заңы мына жағдайларда ғана сақталады:
1) ерітіндідегі жарық жұтатын бөлшектердің құрамы тұрақты болуы және өзгермеуі керек. Ол үшін аналитикалық реакцияның химизміне байланысты жүргізу жолын мұқият қадағалау керек;
2) ерітіндіден өтетін жарық шоғының монохроматты және параллельді болуы керек;
температура тұрақты болуы керек.
28. Тура потенциометрия және рНметрия әдістерінде қолданылатын индикаторлық электродтардың электродтық теңдеуін жазыңыз. Нернст теңдеуін жазыңыз. Электродтық потенциалдың бірінші сандық теориясын 1889 жылы Нернст ұсынған. Бұл теория үш негізгі қағидаларға негізделген:
1. Электродық потенциал металл/ерітінді шекарасындағы потенциалдың секіруімен анықталады;
2. Электродтық потенциал металл мен ерітінді арасында иондардың алмасу нәтижесінде пайда болады;
3. Иондарының алмасуының қозғауыш күші-еріген заттың осмостық қысымы (π) мен металдың еруінің электролиттік серпімділігімен (р) сипатталады.
Бұл екі қарама-қарсы процестерден тұрады:
Электролиттік серпімділік иондардың ерітіндіге ауысына әкеледі, ал осмостық қысым кері әсер етеді.
|
|
|
Егер, р> π, металл беті теріс зарядталады.
p< π, металл беті оң зарядталады.
p=π, металл зарядталмайды.
Металл мен ерітінді шекарасында потенциал айырымы Нернст теориясы бойынша келесі теңдеумен анықталады:

Тепе-теңдік күйдегі металл/ерітінді шекарасындағы потенциалдың секіруі- тепе-теңдік потенциалы деп аталады.
Осмостық қысымы мына теңдікпен анықталады.
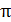 =
= 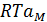 n+
n+
Сонда
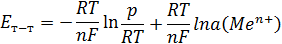
Егер, a=1 моль/л
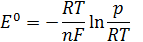
- нормальды, стандартты потенциал – металл табиғатына тәуелді тұрақты шама.
Ал Нернст теңдеуі келесі түрге айналады
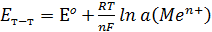 яғни
яғни
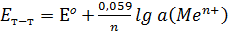
Бұл теңдеу бірінші ретті электродтардың потенциалын анықтауға мүмкіндік береді.
Мысалы Cu/CuSO4, Zn/ZnSO4 т.б.
Егер тотығу-тотықсыздану жүйесі арасындағы электрохимиялық реакциясы ерітінді фазасында жүретін болса,
MnO4- + 8H+ + 5e ↔ Mn2++4H2O
Жүйе потенциалын өлшеуге индифферентті электродтар қолданылады (платина, алтын, көміртекке негізделген модифицирленген электродтар). Жалпы түрде
Ox + ne  Red
Red
 Индикаторлық электродтың потенциалы жүйедегі потенциал анықтаушы иондардың концентрациясына тәуелді болады. Потенциометрия мен потенциометрлік титрлеуде екі түрлі индикаторлық электродтар пайдаланылады:
Индикаторлық электродтың потенциалы жүйедегі потенциал анықтаушы иондардың концентрациясына тәуелді болады. Потенциометрия мен потенциометрлік титрлеуде екі түрлі индикаторлық электродтар пайдаланылады:
1. Металдық және басқа ток өткізгіш индикаторлық электродтар.
2. Мембраналық ионселективті электродтар-сенсорлар.
Индикаторлық электродтар ток өткізетін болуы керек және жүйе компоненттерімен әрекеттеспеуі керек.
Асыл метадар (платина, күміс, алтын – индеферентті электродтар)- инертті металдық электродтар деп аталады. Мұндай электродтардың потенциалдары тотыққан және тотықсызданған заттың түрлерінің жартылай реакцияларына тәуелді. Сонымен қатар индикаторлық электродтар ретінде қайтымды жартылай реакцияларға қатысатын басқа да металдар (Сu, Hg, Pb, Cd, Ni) пайдаланылады. Оларды активті металдық электродтар деп атайды. Оларды аттас иондарды және осы иондармен қатты фаза түзетін аниондарды анықтауға пайдаланылады.Электроанализде индикаторлық электродтар ретінде көміртекті токөткізгіш материалдардан жасалған электродтар жиі пайдаланылады (графит, шыныграфит, пасталы графит т.б.).
29. Титриметрлік анықтаулар түрлері: тура, кері және орын басу.
Титриметриялық әдістерді титрлеу жолына қарап та бөледі;
1. тікелей титрлеу әдісі – анықтайтын зат концентрациясы белгілі ерітіндімен титрленеді;
2. ауыстыру (жанама) әдісі – бұл әдіс анықтайтын зат пайдаланатын реагентпен әрекеттеспейтін, не реакция стехиометриялық жолмен жүрмейтін жағдайда пайдаланылады. Мысалы, кальций иондарын перманганатометрия әдісімен анықтау. Кальций иондарын қымыздық қышқылы аниондарымен тұнбаға түсіреді:
Ca2++C2O42-→CaC2O4↓
Жуылған тұнбаны күкірт қышқылында ерітеді:
CaC2O4↓+2H3O+→H2C2O4+Ca2++2H2O
Пайда болған қымыздық қышқылын калий перманганаты ерітіндісімен титрлейді:
5H2C2O4+2MnO4-+6H3O+ 10CO2+2Mn2++14H2O
3. кері титрлеу әдісі – анализдейтін ерітіндіге артық мөлшерде алынған титранттың белгілі көлемін құяды, яғни анықтайтын компонентпен реакция толық жүргеннен кейін ерітіндіде титранттың бос мөлшері қалады. Реакцияласпай қалған титранттың мөлшерін концентрациясы белгілі басқа ерітіндімен титрлейді. Алғашқы қосылған титранттың көлемі мен оның реакцияласпай артық қалған көлемінің арасындағы айырмашылық титранттың анықтайтын затпен әрекеттесуге кеткен көлемін көрсетеді.
30. Химиялық талдау нәтижелерін метрологиялық өңдеу. Сандық анализдегі жүйелік және кездейсоқ қателіктер, олардың пайда болу себептері. Қателіктердің негізгі сипаттамалары.
Аналитикалық сигнал, оны өлшеу
Анализдің соңғы кезеңінде аналитикалық сигнал ретінде анықталатын компоненттің құрамымен функционалды байланысқан физикалық шаманың орташа өлшемін алады.Бұл ток күші, жүйенің ЭҚК, оптикалық тығыздық, сәулелені қанықтығы (интенсивтігі) және т.б. болуы мүмкін. Қандай да бір компонентті табу қажет болған жағдайда әдетте аналитикалық сигналдың – тұнбаның, бояудың және спектрдегі сызықтың пайда болуын тіркейді. Компоненттің мөлшерін анықтаған кезде аналитикалық сигналдың шамасы – тұнбаның массасы, ток күші, спектр сызығының қанықтығы (интенсивтігі) өлшенеді. Одан кейін аналитикалық сигнал – құрам фукционалды тәуелділігін: y=f(x) қолдана отырып компонент құрамын есептейді. Аналитикалық сигнал – құрам фукционалды тәуелділігін: y=f(x) есептеу әдісімен немесе тәжірибелік жолмен анықтайды және оны формула, таблица немесе график түрінде де беруге болады. Аналитикалық сигнал мен компонент құрамының арасындағы тәуелділікті негізге ала отырып, анықталатын компоненттің концентрациясын табады. Әдетте бұл кезде градуирленген график, стандарттар және қоспалар әдістерін қолданады.
Градуирленген график әдісі. | Градуирленген график әдісі көбірек таралған. Бұл кезде аналитикалық сигнал–компонент құрамы координаттарында анықталатын компоненттің әртүрлі және дәл белгілі құрамдағы салыстырмалы үлгілерін қолдана отырып, график тұрғызады. Одан кейін, анализденетін үлгідегі аналитикалық сигналдың шамасын өлшеп, анықталатын компоненттің құрамын градуирленген график бойынша табады |
Стандарттар әдісінде компоненттің құрамы белгілі салыстыру үлгісіндегі (эталонды үлгі) және анализденетін сынамадағы аналитикалық сигнал өлшенеді: yэт=Scэт және yх=Scх, мұндағы S – пропорционалдық коэффициент. Егер бірдей жағдайларда анықталған S шамасы алдын-ала белгілі болса, онда сх=ух/S формуласы бойынша есептеу жүргізуге болады. Әдетте yэт/yх=cэт/сх қатынасын қолданады, бұдан:
сх=yхcэт/yэт Кейде екі эталонды үлгі қолданады, олардың біреуінде компоненттің құрамы анализденетін сынамадағы болжанған құрамнан аз, екіншісінде көп. Стандарттар әдісінің бұл вариантын кейде шектелген ерітінділер әдісі деп те атайды. Анықталатын компоненттің құрамын мына формуламен есептейді:
| (сэт,2-сэт,1)(ух-уэт,1) уэт,2-уэт,1 |
сх=cэт,1+
Компоненттің аз мөлшерін анықтаған кезде үлгі матрицасының аналитикалық сигналға әсерін ескеру қажет болған жағдайларда көбінесе қоспалар әдісінің есептеу және графиктік тәсілдерін қолданады.
Құрамды есептеу әдісімен анықтаған кезде анализденетін сынаманың ерітіндісінен екі аликвот алады. Олардың біреуіне анықталатын компоненттің құрамы белгілі қоспасын қосады. Екі сынамадағы аналитикалық сигналды өлшейді – ух және ух+қоспа. Анықталатын компоненттің белгісіз концентрациясын мына формуламен есептейді:
| ухVқоспасқоспа ух+қоспаVқоспа+(ух+қоспа-ух)V |
сх=
мұндағы Vқоспа және сқоспа қосылған қоспаның көлемі мен концентрациясы, V – анализденетін сынаманың аликвоты.
Стандарттар әдісі мен қоспа әдісі пропорционалды градуирленген функция үшін қолдануға жарамды. Градуирленген график әдісінде сызықты және сызықты емес аналитикалық сигнал-мөлшер функциясы жарамды. Соңғы жағдайда экспериментальды мәліметтердің саны көбірек болуы керек және компонент мөлшерін анықтау нәтижесінің дәлдігі төмендеу болады.
Экспериментальды мәліметтерді толығырақ қанағаттандыратын градуирленген графикті тұрғызу үшін ең кіші квадраттар әдісін қолданады.
Химиялық анализде жиі анықталатын мөлшерлердің диапазонын, яғни берілген әдістемемен қарастырылған мәндер аумағын анықтау үшін тұрғызылған түзу сызықты градуирленген графиктерді қолданады.
Компоненттің белгісіз мөлшерін анықтайтын барлық әдістерде y=Sx функционалды тәуелділігін қолданады. Сезімталдық коэффициенті S (кейде оны жай ғана сезімталдық деп атайды) аналитикалық сигналдың компонент мөлшеріне сәйкес келуін сипаттайды. Сезімталдық коэффициенті – бұл берілген белгілі мөлшердегі градуирленген функцияның бірінші туындысының мәні. Түзусызықты градуирленген графиктер үшін – бұл түзудің көлбеу бұрышының тангенсі:
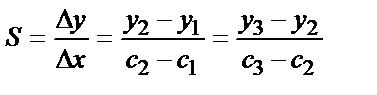
Сезімталдық коэффициенті S неғұрлым үлкен болған сайын, бірдей аналитикалық сигнал алу арқылы анықтауға және ашуға болатын компоненттердің мөлшері соғұрлым аз болады. S жоғары болған сайын аналитикалық сигналды дәлірек өлшеуге болады және заттың бірдей мөлшерін дәлірек анықтауға болады. Сондықтан химиялық анализдің жаңа әдісін немесе әдістемесін жасаған кезде зерттеуші, сезімталдық коэффициентті жоғарылату үшін концентрлеу, құралдарды жетілдіру, жаңа реагенттерді жасау сияқты әртүрлі тәсілдерді қолданады.
Химиялық анализ жүргізген кезде бір ғана анықтаумен шектелмейді, бірдей жағдайларда бір сынама үшін бірнеше параллелді анықтаулар (әдетте 3-5) жүргізеді. Параллелді анықтаулардың орташа нәтижесін анализ нәтижесі деп атайды және 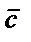 немесе
немесе 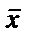 деп белгілейді. Анализ нәтижесінің анықталатын компоненттің шынайы мөлшерінен ауытқуын анықтаудың қателігі деп атайды.Компонент мөлшерін табу немесе анықтаумен қатар алынған нәтиженің дәлдігін, өлшеу қателерін бағалау да өте маңызды.
деп белгілейді. Анализ нәтижесінің анықталатын компоненттің шынайы мөлшерінен ауытқуын анықтаудың қателігі деп атайды.Компонент мөлшерін табу немесе анықтаумен қатар алынған нәтиженің дәлдігін, өлшеу қателерін бағалау да өте маңызды.
Химиялық анализдің қателері. Қателер классификациясы
Әрбір жеке әдістің теориялық және практикалық мәселелеріне қателердің пайда болу көздерін талдауды кіргізу қажет, себебі әрбір әдіске өзіндік ерекшеліктер тән.Қателердің пайда болу жағдайлары мынадай: 1) сынаманың алу кезінде; 2) сынаманы анализге дайындау кезінде; 3) сигналдардың пайда болуы, берілуі және тіркелуі кезінде; 4) анықталатын компоненттердің мөлшерін бағалау кезінде. Қателер кез-келген өлшеулерге серіктес болып келеді. «Қате» деген ұғымның қарапайымдылығы мен дағдылы нәрсе болуына қарамастан, оны теориялық жағынан ұғыну өте күрделі және өлшеудің қолданылу мақсаттары үшін оның маңызы өте зор.Әрбір анализдің нәтижесі (Cөлш.) екі құрамдас бөліктен тұрады: нақты мәннен (Cнақ.) және анализ қатесінен (Қ.):
Cөлш. = Cнақ. + Қ.
Анализдің қатесі деп анализ нәтижесінің өлшенетін ақиқат мәннен ауытқуын айтады. Қатені бірнеше жолмен классификациялауға болады. Қатені көрсету тәсіліне байланысты абсолютті және салыстырмалы деп, байқалу сипатына байланысты – систематикалық (жүйелі) және кездейсоқ, параллельді түрде жүргізілген анықтау нәтижелерін өңдеу тәсіліне байланысты – орташа арифметикалық және орташа квадраттық деп бөледі. Анализдің абсолютті қатесін  деп белгілейді, оны мына теңдеумен анықтайды:
деп белгілейді, оны мына теңдеумен анықтайды:
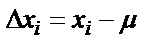 ,
,
бұндағы,  – анализ нәтижесі,
– анализ нәтижесі, 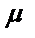 – анализденетін компоненттің сынамадағы ақиқат мөлшері. Абсолютті қатенің өлшенетін ақиқат мәнге қатынасын анализдің салыстырмалы қатесі дейді. Әдетте салыстырмалы қатені пайызбен, кейде бірлік үлесімен де көрсетеді:
– анализденетін компоненттің сынамадағы ақиқат мөлшері. Абсолютті қатенің өлшенетін ақиқат мәнге қатынасын анализдің салыстырмалы қатесі дейді. Әдетте салыстырмалы қатені пайызбен, кейде бірлік үлесімен де көрсетеді:
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2040; Нарушение авторских прав?; Мы поможем в написании вашей работы!