
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамічні процеси ідеальних газів
|
|
|
|
Програма.
Класифікація термодинамічних процесів змінювання стану робочих тіл. Загальна схема дослідження термодинамічних процесів. Аналітичне дослідження ізохорного, ізобарного, ізотермічного, адіабатного і політропного процесів, їхнє графічне зображення в p - v і T - s діаграмах.
Методичні вказівки. Матеріал цієї теми є основою для засвоєння і розуміння особливостей роботи різноманітних теплових машин. Загальна схема дослідження термодинамічних процесів складається з 6 етапів: 1 - запис (виведення) рівняння процесу, 2 - характер змінювання основних параметрів робочого тіла, 3 - аналіз особливостей енергообміну в процесі, 4 - визначення теплоти і роботи змінювання об’єму робочого тіла, 5 - визначення величини зміни калоричних параметрів робочого тіла, 6 - графічне зображення процесу в робочій і тепловій діаграмах. Для успішного засвоєння цієї теми необхідно пам'ятати про загальні і особливі моменти в аналітичних залежностях показників процесів. Деякі з них:
· рівняння процесу записується через основні або калоричні параметри стану робочого тіла;
· змінювання основних параметрів визначається із незмінності рівняння стану для усякої (початкової і кінцевої) точки процесу;
· виходячи з рівняння першого закону термодинаміки ¶ q = ¶ u + ¶ l, можливі чотири особливості енергообміну - коли є усі три складники цього закону і коли будь-яке з трьох дорівнює нулю;
· питома теплота процесу q визначається через добуток теплоємності робочого тіла в цьому процесі на різницю (змінення) температури qi = ci ´ D T;
· змінювання питомої внутрішньої енергії і ентальпії робочого тіла не залежить від характеру процеса і в будь-якому процесі визначається за формулами D u = cv ´ D T, D i = cp ´ D T;
|
|
|
· змінювання питомої ентропії робочого тіла в процесі (за винятком ізотермічного процесу) визначається як добуток теплоємності в цьому процесі на різницю натуральних логарифмів (логарифм відношення) кінцевої і початкової температури D s = ci ´ ln (T2 /T1).
Література: Л. 1, с. 31-39; Л. 2, с. 43-54.
1.6. Реальні гази (пари)
Програма.
Властивості реальних газів. Фазові рівноваги і фазові переходи. Основні поняття і визначення для парів. Фазові діаграми стану. Водяна пара. Таблиці термодинамічних властивостей води і водяної пари на лінії насичення. p - v, T - s і i - s діаграми водяної пари. Побудова термодинамічних процесів водяної пари в p - v, T - s і i - s діаграмах. Розрахунок параметрів процесів водяної пари за допомогою термодинамічних таблиць і i - s діаграми.
Методичні вказівки. Приступаючи до вивчення цієї теми, студент повинен чітко уявляти собі, що розрахункові формули, що застосовувалися для ідеального газу, тут, як правило, недійсні. Для парів немає простого і точного рівняння стану. Рівняння Ван-дер-Ваалься для реального газу враховує внутрішній тиск газу та сили взаємодії між молекулами і має наступний вигляд: 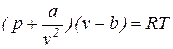 . Рівняння М.П.Вукаловича та І.І.Новікова має більш складний характер, тому що враховує силові асоціації та дисоціації молекул:
. Рівняння М.П.Вукаловича та І.І.Новікова має більш складний характер, тому що враховує силові асоціації та дисоціації молекул:  Тому процеси реальних газів розраховуються за допомогою діаграм. Для водяної пари найбільш широке застосування знайшла i - s діаграма, для робочих тіл холодильних машин - T-s і lg p - i діаграми.
Тому процеси реальних газів розраховуються за допомогою діаграм. Для водяної пари найбільш широке застосування знайшла i - s діаграма, для робочих тіл холодильних машин - T-s і lg p - i діаграми.
Література: Л. 1, с. 92-102; Л. 2, с. 55-68.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1589; Нарушение авторских прав?; Мы поможем в написании вашей работы!