
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория механизмов и машин 2 страница
|
|
|
|
Многоконфигурационный метод ССП (МК ССП) - вариационный метод, в котором приближенная волновая функция Ψ КВ молекулы ищется в виде линейной комбинации волновых функций, отвечающих основному и различным возбужденным электронным конфигурациям Ψk.Параметры разложения МО по АО в Ψk самосогласованно оптимизируются одновременно с коэффициентами аk. Позволяет более полно учесть энергию электронной корреляции, чем метод конфигурационного взаимодействия.
Модель отталкивания электронных пар Гиллеспи -дает приближенный качественный способ предсказания структуры молекул путем решения задачи о размещении максимально удаленных друг от друга точек, символизирующих центры тяжести облаков электронных пар. Приложима к соединениям непереходных элементов. Основные положения: 1) конфигурация связей, образуемых многовалентным атомом, обусловлена числом электронных пар его валентной оболочки, существующих как на связывающих, так и на несвязывающих МО; 2) ориентация облаков плотности электронных пар, описываемых валентными орбиталями, определяется их максимальным взаимным отталкиванием.
Молекулярная структура – набор конформаций молекулы в пределах структурной области ППЭ, сохраняющих одинаковую систему химических связей при разной геометрии.
Молекулярный электростатический потенциал (МЭСП, англ. MEP) - характеризует распределение электростатического поля, создаваемого зарядами ядер и электронов в молекуле. Позволяет объяснить многие явления, связанные с взаимным влиянием молекул в молекулярных ансамблях и твердых телах. Используется в качестве индекса реакционной способности для определения положения реакционных центров в химических реакция с участием «жестких» соединений: атака электрофилов будет направлена на области молекулы, где MЭСП наиболее отрицательный.
|
|
|
Молекулярная динамика – подход, при котором моделируют движение каждого атома в молекулярной системе для того, чтобы наблюдать кинетическое поведение системы и ее свойства в равновесии. Траектории движения молекул рассчитывают методами молекулярной механики или полуэмпирическими квантово-механическими методами. В результате получают структурные и термодинамические свойства, включая альтернативные локальные минимумы и разность энергий различными конфигурациями.
Молекулярная механика (MM) -метод определения молекулярной структуры, основанный на представлении молекулы в виде набора точек определенной массы, удерживаемых классическими силами. Вклады в молекулярную энергию включают упругую энергию связи (описывается законом Гука), энергии изгиба валентных углов и пространственных угловых деформаций и энергии электростатических и ван-дер-ваальсовых взаимодействий. Позволяет минимизировать энергию для больших систем, содержащих много тысяч атомов, при разумных вычислительных затратах. Результаты зависят от параметризации силового поля. Может также служить как вычислительная модель для оценки потенциальной энергии молекулы с учетом всех степеней свободы. Неприменим 1) для моделирования систем, свойства которых определяются электронными эффектами типа орбитальных взаимодействий и 2) в случае разрыва связей.
Модифицированное промежуточное пренебрежение дифференциальным перекрыванием (МПДП, англ. MINDO) – модифицированный метод INDO. Параметризация резонансных (bnm) и кулоновских (gAB) интеграловизменена таким образом, чтобы обеспечить возможность расчета теплот образования, орбитальных энергий, спектров, поверхностей потенциальной энергии. Так, резонансные интегралыbnm рассчитываются в MINDO по формуле bnm=GAB (Im +In)Snm, где GAB – безразмерный эмпирический параметр, характеризующий типы взаимодействующих атомов. Двухэлектронные кулоновские интегралы gAB вычисляются по формуле gAB = (r2nm + a2nm)-1/2. Кроме того, отталкивание атомных ядер вычисляется с учетом их экранирования электронами остовов.
|
|
|
Версия MINDO/3 (параметризуемыми свойствами здесь служат теплоты образования, причем параметры зависят от свойств как атомов, так и их парных комбинаций. Кроме того, орбитальные экпоненциальные множители, используемые для расчета интегралов, также являются параметрами.обеспечивает довольно точные значения молекулярных свойств для больших органических молекул), в частности, с химической точностью позволяет рассчитывать теплоты образования различных классов органических молекул, тепловые эффекты химических реакций.
Молекулярная орбиталь – приближенная волновая функция одного электрона в молекуле, вычисленная в приближении самосогласованного поля (обычно как линейная комбинация атомных орбиталей, МО ЛКАО). Делокализована по всему пространству молекулы.
MOPAC - комплекс полуэмпирических программ, разработанный Дж.Стюартом (J.J.P. Stewart). Применяется при расчете электронной структуры основного и возбужденных состояний атомов, молекул и твердых тел. В MOPAC реализованы полуэмпирические методы MINDO/3, MNDO, AM1 и PM3. Последняя версия программы MOPAC-2002 позволяет рaссчитывaть биомолекулы (> 10 000 aтомов), нa основе использовaния локaлизовaнных молекулярных орбитaлей, соединения 3d- и 4d металлов, возбужденные и основные состояния молекул в растворе, зонную структуру твердых тел.
Мультиплетность состояния (spin multiplicity) – определяется числом возможных значений проекций полного спинового момента электронов системы S и равна 2S + 1. Каждый электрон имеет значение спина ± (½)ħ. Система с закрытой оболочкой имеет мультиплетность 1 (синглетное состояние). Система с открытой оболочкой может иметь мультиплетность 2, 3, 4 (дублетное, триплетное или квартетное состояния) или выше.
Неограниченный (по спину) метод Хартри-Фока (НХФ, англ. UHF) -метод самосогласованного решения уравнения Шредингера, в котором многоэлектронная волновая выбирается в виде единственного детерминанта Слейтера, построенного из спин-орби-талей, в которых электроны с различным направлением спина описывают различными пространственными функциями. Требование быть собственной функцией оператора квадрата полного спина системы S2 на волновую функцию не накладывается. Требует больше времени, чем расчет RHF, но обеспечивает большую гибкость волновой функции. Как правило, применяется для систем с открытыми оболочками, обеспечивая более низкое значение энергии. Приспособлен для расчета реакций диссоциации в системах с закрытыми оболочками.
|
|
|
НСМО (LUMO) - низшая свободная (вакантная, незанятая) молекулярная орбиталь. Согласно теореме Купманса, энергия НСМО молекулы приближенно равна сродству к электрону.
Неподеленная пара электронов – пара электронов валентной оболочки, не принимающая участия в образовании химической связи. Электроны на локализованных несвязывающих орбиталях обычно рассматриваются как нуклеофильные центры, легко образующие электрон-донорную связь с электроположительным центром.
Нормальные координаты – координаты, в базисе которых матрица Гессе диагональна.
Нормировка волновой функции – согласно статистической интерпретации волновой функции, величина ψ*(r)ψ(r)dv пропорциональна вероятности обнаружения частицы в элементе объема dv, окружающем точку r. Вероятность нахождения частицы в пространстве определяется интегралом ∫dv ψψ*, который должен быть равен единице. Поэтому перед интегралом ставят коэффициент пропорциональности, который выбирают так, чтобы обеспечить равенство интеграла единице - другими словами, нормируют волновую функцию на единицу.
Обменный интеграл – интеграл, описывающий вклад в полную энергию системы, учитывающий понижение энергии отталкивания электронов с параллельными спинами на разных орбиталях вследствие принципа Паули. В рамках классических представлений интерпретация невозможна.
Ограниченный (по спину) метод Хартри-Фока (ОХФ, англ. RHF) -метод самосогласованного решения уравнения Шредингера, в котором многоэлектронная волновая выбирается в виде единственного детерминанта Слейтера, построенного из пространственных орбиталей, занятых парой электронов с противоположными спинами. Используется для систем с открытой и закрытой оболочкой. См. также неограниченный метод Хартри-Фока (НХФ, англ. UHF).
|
|
|
Одноэлектронное приближение – модель, в которой движение каждого электрона предполагается происходящим в поле ядер и в усредненном поле остальных электронов.
Оператор -символ, обозначающий математическую операцию, с помощью которой из одной функции получается другая. Каждому оператору отвечает уравнение на собственные значения А f = af, a - в общем случае комплексное число, называемое собственным значением оператора А, f называется собственной функцией оператора А.
Оператор кинетической энергии молекулы - T =  , где Мa- масса ядра a; m - масса электрона;
, где Мa- масса ядра a; m - масса электрона; 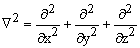 - оператор Лапласа (лапласиан). Дифференцирование ведется по координатам ядер Ra и по координатам электронов ri. Оператор описывает кинетическую энергию электронов и ядер.
- оператор Лапласа (лапласиан). Дифференцирование ведется по координатам ядер Ra и по координатам электронов ri. Оператор описывает кинетическую энергию электронов и ядер.
Оператор потенциальной энергии молекулы -
V = 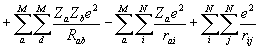 , где
, где  и
и  - атомный номер элемента, e - заряд электрона, Rab - расстояние между ядрами, rai - расстояние между ядрами и электронами, rij- между электронами, e0 – электрическая постоянная. Оператор описывает отталкивание ядер, притяжение электронов к ядрам и отталкивание электронов.
- атомный номер элемента, e - заряд электрона, Rab - расстояние между ядрами, rai - расстояние между ядрами и электронами, rij- между электронами, e0 – электрическая постоянная. Оператор описывает отталкивание ядер, притяжение электронов к ядрам и отталкивание электронов.
Оптимизация геометрии молекулы– поиск устойчивой конфигурации молекулы, отвечающей локальному или глобальному энергетическим минимумам.
Орбитали слейтеровского типа (ОСТ или STO) – функции, аппроксимирующие атомные орбитали. В сферических координатах  имеют вид
имеют вид 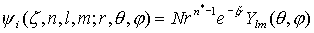 .Здесь
.Здесь 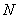 – нормировочный множитель,
– нормировочный множитель,  - орбитальная экспонента,
- орбитальная экспонента, 
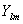 - сферическая гармоника, n, l, и m - квантовые числа. Орбитали слейтеровского типа правильно описывают асимптотическое поведение электронов как вблизи ядра, так и на больших расстояниях от него.
- сферическая гармоника, n, l, и m - квантовые числа. Орбитали слейтеровского типа правильно описывают асимптотическое поведение электронов как вблизи ядра, так и на больших расстояниях от него.
Орбитали гауссова типа (ОГТ или GTO) функции, аппроксимирующие атомные орбитали. В декартовых координатах x, y, и z имеют вид  , где
, где 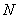 – нормировочный,
– нормировочный, 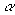 - орбитальный экспоненциальный множитель, r2= x2 + y2 + z2. Числа l и m определяют угловую часть ОГТ в декартовых координатах: их сумма (l+м+n) аналогична угловому квантовому числу для атомов и используется, чтобы обозначать функции s-типа (l=0), p-типа (l=1), d-типа (l=2), f-типа (l=3), и т.д. Строго говоря, декартовы ОГT не являются орбиталями: они лишь простые и удобные математические функции, которые часто называют гауссовыми примитивами.
- орбитальный экспоненциальный множитель, r2= x2 + y2 + z2. Числа l и m определяют угловую часть ОГТ в декартовых координатах: их сумма (l+м+n) аналогична угловому квантовому числу для атомов и используется, чтобы обозначать функции s-типа (l=0), p-типа (l=1), d-типа (l=2), f-типа (l=3), и т.д. Строго говоря, декартовы ОГT не являются орбиталями: они лишь простые и удобные математические функции, которые часто называют гауссовыми примитивами.
Ортогональные волновые функции – две функции ψ1 и ψ2 являются ортогональными, если интеграл S12= ∫dv ψ*1(r) ψ2(r) равен нулю. S12 называется интегралом перекрывания. Ортогональными являются собственные функции эрмитового оператора, соответствующие различным собственным значениям.
Особые точки скалярной функции – точки, в которых значения первых производных функции по аргументам равны нулю. Различают следующие типы особых точек: минимум, максимум, локальный минимум (а), седловая точка (б), максимум (в).

Особые точки поверхности потенциальной энергии – точки на поверхности потенциальной энергии (ППЭ), в которых выполняется условие стационарности: производная от потенциальной энергии U по всем нормальным колебательным координатам Qi (координат Qi, в базисе которых матрица Гессе диагональна) равна нулю: ¶U/¶Qi = 0, i = 1, 2,…, 3N–6(5). В минимуме, отвечающем равновесному состоянию системы, все собственные значения матрицы вторых производных потенциальной энергии по координатам (матрицы Гессе Нij=¶2 U/¶Qi¶Qj) положительны: Нii = ¶2U/¶Qi2 > 0. В седловой точке, отвечающей переходному состоянию - одномерном локальном максимуме - из нормальных координат одно и только одно из собственных чисел гессиана отрицательно. При квантово-химическом описании химических реакций предполагают, что реагентам, продуктам, пред- и послереакционным комплексам соответствуют локальные минимумы, а переходному состоянию – седловая точка ППЭ химической реакции.
Параметризация силового поля – подбор параметров для расчета потенциальных функций, определяющие так называемое силовое поле молекулы. Численное значение параметров выбирается так, чтобы получить согласие рассчитанных и экспериментальных характеристик молекулы. Параметрами являются равновесные межъядерные расстояния (длины связей) и валентные углы, а также силовые постоянные, то есть коэффициенты жесткости упругих сил, связывающих пары атомов. Простейшие модели молекулярной механики учитывают растяжения связей (Uраст.), деформацию валентных (Uдеф.) и двугранных (торсионных) углов (Uторс.), взаимодействие валентно несвязанных атомов, называемое также ван-дер-ваальсовым взаимодействием (Uвдв.), электростатические вклады (Uэл-стат.) и т.д.:
U = SUраст + SUдеф + SUторс + SUвдв + SUэл-стат.
Для каждого слагаемого записывается определенное аналитическое выражение (например, энергия электростатического вклада Uэл-стат описывается кулоновской функцией, возможно, с нецелыми зарядами на атомах в качестве параметров). Для описания потенциальной функции предельных углеводородов при умеренных требованиях к точности расчета достаточно около десяти параметров.
Правило 18 электронов - в устойчивых комплексах переходных металлов МLn общее число валентных электронов на связях M-L и несвязывающих молекулярных орбиталях центрального атома равно 18.
p-электронное приближение - при решении уравнений Рутана для ненасыщенных и ароматических молекул, чаще всего являющихся плоскими, s-АО считают неполяризованными и включают в атомный остов, а движение p-электронов рассматривают в потенциальном поле таких остовов. Волновая функция молекулы при этом представляется как произведение y = ys yp, где ys и yp - нормированные антисимметричные по отношению к s- и p-электронам функции, соответственно. Их можно разложить по слейтеровским детерминантам, составленных только из s- и только из p-МО. Волновая функция ys одинакова как для основного, так и для возбужденных состояний и все изменения связываются с p-электронами. Рассмотрение только p-электронов удовлетворяет вариационному принципу.
Поверхность потенциальной энергии – представление потенциальной энергии молекулярной системы как многомерной функции всех переменных (степеней свободы) в системе (например, длин связей и углов между ними). Потенциальная поверхность для молекулы с N атомами имеет 3N-6 независимых степеней свободы (три степени отвечают вращению и три - движению молекулярной системы). Важными особенностями потенциальной поверхности являются минимумы и седловые точки, которые представляют структуры переходных состояний, которые находят, оптимизируя геометрию молекул.
Полуэмпирические методы расчета – группа расчетных методов квантовой химии, использующих отказ от вычисления одноэлектронных и двуэлектронных интегралов, фигурирующих в методе ХФ. Вместо точного оператора Фока используется приближенный, элементы которого получают из эмпирических данных. Соответствующие параметры подбирают для каждого атома (иногда - с учетом конкретного окружения) и для пар атомов: таким образом, они являются либо фиксированными числами, либо зависят от расстояния между атомами.
Полуэмпирические методы намного быстрее, чем неэмпирические. Они применимы к большим (часто к очень большим, например - биологическим) системам и для некоторых классов соединений дают очень точные результаты. Однако это достигается за счет специально подобранных параметров, справедливых лишь в пределах узкого класса соединений. При переносе на другие классы, те же методы могут дать абсолютно неверные результаты. Кроме того, параметры расчета часто подбираются таким образом, чтобы воспроизводить те или иные молекулярные свойства, поэтому придавать физический смысл отдельным параметрам не следует.
Пренебрежение дифференциальным перекрыванием (NDO) – упрощение, применяемое в полуэмпирических квантово-механических расчетах. Считают, что из-за экспоненциального убывания АО двухэлектронными кулоновскими и обменными интегралами, содержащими произведения различных атомных орбиталей, зависящих от одного аргумента, можно пренебречь. Уменьшает число интегралов, описывающих в расчете взаимодействия электронов.
Полное пренебрежение дифференциальным перекрыванием (ППДП, англ. CNDO) - один из первых полуэмпирических методов. Используется для вычисления электронных свойств основного состояния систем с закрытой оболочкой, оптимизации геометрии и общей энергии. В настоящее время заменен более сложными полуэмпирическими квантово-химическими методами, такими как MNDO, AM1 и PM3.
Принцип сохранения орбитальной симметрии Вудворда-Хоффмана – носит общий характер и позволяет в ряде случаев предсказывать, будут ли соединения реагировать, по какому пути пойдет реакция и каких продуктов следует ожидать. Рассматриваются структура активных МО реагирующих веществ и знаки атомных орбиталей (АО), составляющих МО. Реакция называется разрешенной по симметрии, если в ходе ее симметрия активных МО (все участвующие в реакции занятые и вакантные МО реагентов и продуктов) сохраняется. Деление реакций на разрешенные и запрещенные по симметрии осуществляется с помощью корреляционных диаграмм. Корреляционную диаграмму взаимодействия между реагентами и продуктом строят простым соединением МО с одинаковой симметрией (S ® S и A ® A), учитывая, что разность энергий МО должна быть минимальна. Если это возможно и ни одна из соединяющих линий не пересекает нулевого уровня (правило непересечения), то реакция «разрешена» по симметрии.
Поляризационные функции – базисные функции, описывающие поляризацию орбиталей атомов соседями по молекуле. Состоят из функций с более высокими значениями орбитального квантового числа l, чем те, которые отвечают минимальному базису. p- и d-функции выступают как поляризационные функции для базисных функций для атомов с s электронами, d- и f- функции действуют как поляризационные функции для атомов с s и p электронами и д.т.
Порядок связи – мера простого, двойного или тройного характера связи. В теории молекулярных орбиталей в основу определения положен учет компенсации эффектов занятых электронами связывающих и разрыхляющих орбиталей (см. кратность связи по Герцбергу).
Постулат Хэммонда -связывает геометрию переходного состояния с тепловым эффектом реакции. По Хэммонду экзотермическим реакциям соответствует реагентоподобное переходное состояние, эндотермическим – продуктоподобное, теплонейтральным – лежащее примерно по середине между реагентами и продуктами.
Потенциал Букингема -основан на предположении об экспоненциальной зависимости сил отталкивания между молекулами от расстояния между ними. Используетсядля описания ван-дер-ваальсовых взаимодействий. Энергия взаимодействия между молекулами в этом случае зависит от расстояния R между ними: U(R) = be-aR – cR-6 – dR-8; a, b, c, d – постоянные. Это выражение справедливо только для неполярных сферически-симметричных молекул. Для расчета энергии взаимодействия более сложных систем в эмпирический потенциал вводят поправки. Чаще всего расчеты проводят с использованием упрощенного потенциала Букингема, в котором пренебрегают членом, включающим R-8, и рассматривают полное взаимодействие как сумму взаимодействий между всеми атомами подсистем.
Потенциал Леннарда-Джонса – служит для расчета энергии межмолекулярного взаимодействия. Основан на предположении о быстром возрастании сил отталкивания между молекулами на малых расстояниях, происходящем по закону R-n. Потенциал Леннарда-Джонса (6-12) получают при n = 12, зависимость R-6 в этом случае отражает наличие дисперсионных сил. Потенциальная энергия взаимодействия между системами не имеющими постоянных диполей описывается выражением U(r) = 4ε [(σ/r)12 - (σ/r)6], где ε и σ – эмпирические константы, r – расстояние между взаимодействующими системами; (σ/r)12- описывает отталкивание, (σ/r) 6 – описывает притяжение между системами.
Потенциал ионизации - энергия, которую необходимо сообщить системе, чтобы удалить какой-либо из ее электронов. По потенциалу ионизации можно судить о прочности связи электрона данной орбитали с атомным остовом.
Предел сходимости - вычисление методом ССП заканчивается, когда различие в энергии после двух последовательных итераций становится меньше, чем некая малая величина величина. Для полуэмпирических вычислений практический предел сходимости равен примерно 10-3 (по умолчанию 0,01 ккал/моль), для неэмпирических - 10-4-10 -5.
Приближение Борна-Оппенгеймера состоит в отделении движения ядер от электронного движения. Ядра намного тяжелее электронов и их можно считать неподвижными, рас-сматривая движение электронов относительно них. Уравнение Шредингера тогда может быть решено только для электронов при определенной ядерной конфигурации. Оправдано при квантово-химическом анализе поведения молекул в основном состоянии.
Приближение независимых частиц – наличие электрон-электронного отталкивания в гамильтониане не позволяет разделить координаты электронов и решить уравнение Шредингера аналитически для системы более двух электронов. Поэтому поведение каждого электрона описывается некоторой волновой функцией, подобно единственному электрону в атоме водорода, и зависит от поведения остальных электронов в среднем. В этом состоит суть приближения независимых частиц. Решения одноэлектронных уравнений – уравнений Хартри-Фока или Кона-Шэма – называются одноэлектронными волновыми функциями или орбиталями (в атоме - атомными орбиталями, в молекуле - молекулярными, в кристалле - кристаллическими). Для их расчета используется приближение самосогласованного поля.
Приближение самосогласованного поля (ССП) -в приближении независимых частиц действие всех остальных электронов на данный электрон заменяют средним полем, приближенно воспроизводящим их суммарное действие. Приближенная волновая функция (орбиталь) зависит от координат только рассматриваемого электрона: это дает возможность разделить переменные в уравнении Шредингера в сферической системе координат. Чтобы решить систему одноэлектронных уравнений с гамильтонианом, включающим усредненное межэлектронное взаимодействие, задают некоторый набор одноэлектронных функций, максимально близких к правильным, и с их помощью строят оператор, учитывающий отталкивание электронов. Затем решают набор одноэлектронных уравнений, возникающий из условия минимума среднего значения гамильтониана, вычисляемого с одноэлектронной волновой функцией. Полученные решения используют, чтобы построить "исправленный" оператор, вновь решают ту же систему уравнений, но теперь – с новым гамильтонианом и т.д. Процесс продолжается, пока получаемые собственные значения одноэлектронных энергий будут отличаться от полученных на предыдущей итерации лишь на очень незначительную величину. Этот процесс называется самосогласованием, а результирующее поле, создающее усредненный потенциал, называется самосогласованным полем.
Приближение центрального поля. Потенциал межэлектронного взаимодействия только в частных случаях (положительные одноэлектронные ионы, атомы инертных газов, атомы N, P и т.д.) сферически симметричен. Однако учет асферичности не улучшает заметно результат расчета, поэтому обычно используют усредненный по всем направлениям атомный потенциал, интегрируя его по углам. Вводимое таким образом приближение центрального поля позволяет рассматривать ССП-решения для любого атома как модифицированные решения для одноэлектронного водородоподобного атома. В этом случае потенциальная энергия зависит только от расстояния до ядра, т.е. сила притяжения к ядру носит центральный характер. Тогда переменные в уравнении Шредингера в сферических координатах разделяются и волновые функции, описывающие состояния электронов атома в пространстве (атомные орбитали), можно получить в аналитическом виде.
Растяжение связи - в эмпирической теории силового поля описывает изменение молекулярной потенциальной энергии при отклонение длины связи от равновесной. В классической теории силового поля термин растяжение связи представлен гармонической функцией.
Рентгеноструктурный анализ -рентгендифракционное исследование дает трехмерную атомную структуру веществ в кристаллическом состоянии. Эта структура отвечает минимальной энергией конформационных состояний или близкой к минимуму энергии. Атомные координаты, основанные на данных рентгеновской дифракции, часто используются для подготовки входных данных для квантово-химических расчетов. Они также могут служить как первичные данные для конформационного анализа. Анализ молекулярной упаковки дает также информацию о межмолекулярных контактах и межмолекулярных водородных связях.
РМХ (англ. - EHT) - расширенный метод Хюккеля - о дин из простейших полуэмпирических методов. Сформулирован Р. Хоффманном в начале шестидесятых годов. Не является методом самосогласованного поля. Расширенным методом Хюккеля получаюткачественное или полуколичественное описание молекулярных орбиталей и электронных свойств (например, заряды на атомах и распределение спиновой плотности). Удовлетворительно описывает распределение электростатического молекулярного потенциала (МЭСП). Не пригоден для оптимизации геометрии или молекулярно-динамических вычислений.
PM3 (параметрическая модель 3) - версия параметризации метода AM1; дает лучшие оценки теплот образования.
Свободная валентность – разность между максимально возможным полным порядком связи атома и его полным порядком связи в конкретном соединении. Отражает неполноту насыщения валентных возможностей данного атома.
Сгруппированные орбитали (СОГТ) – базисные функции, которые является линейной комбинацией гауссовых примитивов.
Секулярное уравнение – уравнение, возникающее при вариационном решении уравнения Шредингера путем минимизации выражения для энергии по варьируемым параметрам (коэффициентам разложения многоэлектронной волновой функции по частным волновым функциям φi):
| Hij - ESij| = 0.
Здесь Hij – матричный элемент оператора Гамильтона в базисе некоторых функций φi, Е – энергия состояния системы, Sij – элемент матрицы интегралов перекрывания функций φi.
Силовое поле - используется в молекулярной механике, представляет собой функцию потенциальной энергии молекулы от координат ядер атомов (силы, действующие на атомы, представляются в виде функций координат атомов). Определяется через потенциальные функции (представляющими собой, например, суммы парных потенциалов взаимодействия атомов), которые содержат некоторые параметры, численное значение которых выбирается оптимальным образом так, чтобы получить согласие рассчитанных и экспериментальных характеристик молекулы. В простейшем случае параметрами являются равновесные межъядерные расстояния (длины связей) и валентные углы, а также силовые постоянные, то есть коэффициенты жесткости упругих сил, связывающих пары атомов. При использовании в молекулярной механике основываются на допущении возможности переноса этих параметров из одной молекулы в другую, так что численные значения параметров, подобранные для некоторых простых молекул, используются далее при прогнозировании свойств других более сложных соединений.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 936; Нарушение авторских прав?; Мы поможем в написании вашей работы!