
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
І. Теоретичні відомості. 11. На чому ґрунтується спектральний метод дослідження речовин?
|
|
|
|
ВИЗНАЧЕННЯ СТАЛОЇ ПЛАНКА ЗА СПЕКТРОМ ВОДНЮ
V. Контрольні питання
11. На чому ґрунтується спектральний метод дослідження речовин?
12. Як формулюються перший та другий постулати Бора?
13. Як сформулювати та записати умову квантування моменту імпульсу?
14. Яка формула n -го радіуса стаціонарної орбіти атома?
15. За якими формулами визначаються кінетична та потенціальна енергії електрона в атомі водню?
16. За якою формулою визначається повна енергія електрона в атомі водню?
17. Яка формула Бора для частоти випромінювання (поглинання) світла електроном при його переході з одного стаціонарного рівня на інший?
18. Що таке спектральна серія?
19. Як отримати серії Лаймана, Бальмера, Пашена?
20. Яка воднева серія знаходиться у видимій області і спостерігається в даній роботі?
21. Як побудувати дисперсійну криву?
Лабораторна робота № 121
Прилади і матеріали: спектроскоп, установка з гелієвою та водневою трубками.
Мета роботи: оволодіти методикою визначення сталої Планка.
Пропустимо світло від розжареного твердого або рідкого тіла через скляну тригранну призму. На екрані за призмою отримаємо суцільну кольорову смугу. Цю картину називають суцільним (неперервним спектром). Якщо джерелом світла є розжарений газ або пара, що перебувають в атомарному або в іншому стані, то одержимо кілька яскравих ліній на темному фоні. Такий спектр називають лінійчатим. Якщо джерелом світла є розжарені гази або пара, що перебувають у молекулярному стані, одержимо смугастий спектр. Він складається з окремих смуг, розділених темними проміжками. Природу спектрів пояснює тільки квантова теорія.
Розглянемо лінійчаті спектри, утворення яких вперше теоретично пояснив Нільс Бор. Теорія Бора для атома водню та водневоподібних атомів ґрунтується на планетарній моделі будови атома за Резерфордом та двох постулатах, які суперечать законам класичної фізики. Тому теорія Бора, яка використовує закони класичної фізики і постулати, які є положеннями квантової теорії, є напівкласичною. Сформулюємо постулати Бора:
|
|
|
3) електрон в атомі має декілька дискретних дозволених енергетичних станів (стаціонарних станів), перебуваючи в яких він не випромінює і не поглинає енергії;
4)  випромінювання і поглинання енергії може відбуватися тільки при переході електрона з одного стаціонарного рівня Е 1на інший Е 2. При цьому енергія фотона h n, який випромінюється або поглинається, дорівнює різниці енергій початкового і кінцевого станів (рис.1):
випромінювання і поглинання енергії може відбуватися тільки при переході електрона з одного стаціонарного рівня Е 1на інший Е 2. При цьому енергія фотона h n, який випромінюється або поглинається, дорівнює різниці енергій початкового і кінцевого станів (рис.1):
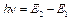 . (1)
. (1)
З усіх можливих орбіт електрона стаціонарним станам відповідають ті, для яких момент імпульсу кратний числу 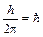 . Тому умова квантування орбіт запишеться як
. Тому умова квантування орбіт запишеться як
m×u×r = h× n, (2)
де m – маса електрона; u – швидкість електрона; r – радіус дозволеної колової орбіти електрона; n = 1, 2, 3 ,... – головне квантове число. Оскільки між негативно зарядженим електроном та позитивно зарядженим ядром діє сила кулонівського притягання, для доцентрової сили (у вакуумі) з другого та третього законів Ньютона отримаємо:
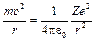 , (3)
, (3)
де Ze – заряд ядра, е – заряд електрона; u – швидкість електрона; e0 – діелектрична стала. З (2) і (3) знайдемо швидкість електрона на стаціонарній орбіті:
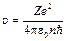 . (4)
. (4)
Підставивши (4) у (2), знайдемо радіус n -ї орбіти:
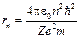 . (5)
. (5)
Тоді повна енергія електрона на n -му рівні у воднеподібній системі складається із його кінетичної енергії (mu 2/2 = Ze2 /(8pe0 r)) та потенціальної енергії в електростатичному полі ядра (– Ze2 /(4pe0 r)):
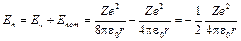 . (6)
. (6)
Врахувавши квантовані значення радіуса для n -ї орбіти електрона (5), отримаємо:
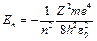 . (7)
. (7)
Знак “–“ означає, що електрон перебуває у зв’язаному стані. Зазначимо ще раз, що ціле число n, яке у (7) визначає енергетичні рівні атома, називається головним квантовим числом. Енергетичний стан з n = 1 є основним (нормальним, незбудженим) станом, стани з n > 1 – збудженими. Енергія, що відповідає основному станові атома водню (Z = 1, n = 1) дорівнює –13,55 еВ. Це енергія, яку необхідно надати електронові, щоб вивести його за межі атома. Тому її ще називають енергією іонізації.
|
|
|
Користуючись правилом частот Бора (1), визначимо частоту світлової хвилі, яка випромінюється атомом при переході з вищого рівня (n = ni) на нижчий (n = nk):
 , (8)
, (8)
або
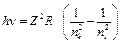 , (9)
, (9)
де 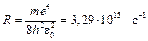 – стала Рідберга. Перехід електрона на перший енергетичний рівень (nk = 1, ni = 2, 3, 4,…) утворює серію Лаймана; на другий (nk = 2, ni = 3, 4, 5,…) - серію Бальмера; на третій (nk = 3, ni = 4, 5, 6,…) - серію Пашена. Група спектральних ліній з однаковим nk, тобто при переходах електронів на один і той же рівень, називається спектральною серією.
– стала Рідберга. Перехід електрона на перший енергетичний рівень (nk = 1, ni = 2, 3, 4,…) утворює серію Лаймана; на другий (nk = 2, ni = 3, 4, 5,…) - серію Бальмера; на третій (nk = 3, ni = 4, 5, 6,…) - серію Пашена. Група спектральних ліній з однаковим nk, тобто при переходах електронів на один і той же рівень, називається спектральною серією.
Серія Бальмера лежить у видимій ділянці спектра. Для обчислення сталої Планка h за спектром водню використаємо (9), врахувавши, що  , а Z = 1:
, а Z = 1:
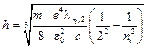 , (10)
, (10)
де m = 9,1×10-31 кг, е = 1,6×10-19 Кл, e0 = 1,6×10-19 Ф/м, с = 3×108 м/с. Формула (10) є робочою для обчислення сталої Планка. Отже, для обчислення сталої Планка h треба мати довжину хвилі l (у даному випадку ту, яка відповідає переходу з третьої орбіти на другу – l32(Ha - червона лінія); з четвертої орбіти на другу – l42(Hb - зелено-голуба лінія); з п’ятої орбіти на другу – l52(Hg – синя лінія)). Ці лінії найбільш яскраві у спектрі водню.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 465; Нарушение авторских прав?; Мы поможем в написании вашей работы!